
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Силы и потенциальная энергия межмолекулярного взаимодействия
|
|
|
|
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях.
При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому возникает необходимость учитывать объем молекул и взаимодействие между ними.
 Так, в 1 м3 газа при нормальных условиях содержится
Так, в 1 м3 газа при нормальных условиях содержится  молекул, занимающих объем примерно
молекул, занимающих объем примерно  м3 (радиус молекулы примерно
м3 (радиус молекулы примерно  м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм=101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм=101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотрении реальных газов —
газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях  м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В XX в., по мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния  между молекулами, где
между молекулами, где  и
и 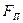 — соответственно силы отталкивания и притяжения, a
— соответственно силы отталкивания и притяжения, a  — их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
— их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
На расстоянии 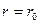 результирующая сила
результирующая сила  , т. е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние
, т. е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние  соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения.
соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения.
При  — преобладают силы отталкивания (
— преобладают силы отталкивания (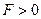 ), это является просто выражением того факта, что молекула занимает некоторую область пространства и препятствует другим молекулам проникать в эту область. Эти силы проявляются в очень малой области, порядка размеров молекулы.
), это является просто выражением того факта, что молекула занимает некоторую область пространства и препятствует другим молекулам проникать в эту область. Эти силы проявляются в очень малой области, порядка размеров молекулы.
при 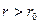 — преобладают силы притяжения (
— преобладают силы притяжения ( ). Эти силы имеют электростатический характер. Они возникают вследствие того, что при небольшом смещении отрицательных и положительных зарядов в нейтральной молекуле она перестает быть нейтральной и превращается в диполь, диполи ориентируются относительно друг друга и суммарная сила притяжения между зарядами диполя будет больше, чем суммарная сила отталкивания. Поэтому полярные молекулы притягиваются.
). Эти силы имеют электростатический характер. Они возникают вследствие того, что при небольшом смещении отрицательных и положительных зарядов в нейтральной молекуле она перестает быть нейтральной и превращается в диполь, диполи ориентируются относительно друг друга и суммарная сила притяжения между зарядами диполя будет больше, чем суммарная сила отталкивания. Поэтому полярные молекулы притягиваются.
На расстояниях 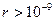 м межмолекулярные силы взаимодействия практически отсутствуют (
м межмолекулярные силы взаимодействия практически отсутствуют ( ).
).
Элементарная работа  силы
силы  при увеличении расстояния между молекулами на
при увеличении расстояния между молекулами на 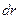 совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
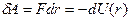 (1.1)
(1.1)
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 88, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют ( ), то
), то  .
.
При постепенном сближении молекул между ними появляются силы притяжения ( ), которые совершают положительную работу
), которые совершают положительную работу 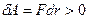 . Тогда, согласно (1.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при
. Тогда, согласно (1.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при 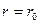 .
.
При  с уменьшением
с уменьшением  силы отталкивания (
силы отталкивания (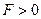 ) резко возрастают и совершаемая против них работа отрицательна
) резко возрастают и совершаемая против них работа отрицательна  . Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (
. Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (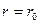 ) обладает минимальной потенциальной энергией.
) обладает минимальной потенциальной энергией.
Более точно характеристика  может быть дана лишь конкретно для данных молекул. Какой-либо универсальной формулы, пригодной для всех молекул, не существует. Обычно функция
может быть дана лишь конкретно для данных молекул. Какой-либо универсальной формулы, пригодной для всех молекул, не существует. Обычно функция  аппроксимируется формулой вида
аппроксимируется формулой вида
 , (1.2)
, (1.2)
в которой постоянные 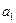 ,
,  ,
,  ,
, 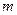 подбираются из требований наилучшей аппроксимации реального потенциала. Как показало исследование потенциалов, в большинстве случаев хорошим приближением является
подбираются из требований наилучшей аппроксимации реального потенциала. Как показало исследование потенциалов, в большинстве случаев хорошим приближением является 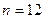 и
и  при
при 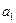 и
и  уточняемых для конкретных атомов.
уточняемых для конкретных атомов.
Критерием различных агрегатных состояний вещества является соотношение величин 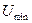 и
и  , где
, где 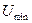 — наименьшая потенциальная энергия взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (
— наименьшая потенциальная энергия взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (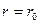 ); kT — определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического теплового движения молекул.
); kT — определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического теплового движения молекул.
 Если
Если 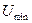 <<
<<  , то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния  , т. е. вероятность образования агрегатов из молекул достаточно мала. В газообразном состоянии система не сохраняет ни формы ни объема.
, т. е. вероятность образования агрегатов из молекул достаточно мала. В газообразном состоянии система не сохраняет ни формы ни объема.
Молекулярное движение выглядит так, большую часть времени молекула движется без взаимодействия, затем в небольшой области меняет направление движения, в результате столкновения с другой молекулой. Расстояние, пролетаемое молекулами между столкновениями, в сотни раз больше (сотни тысяч) диаметра молекул. Одновременное столкновение трех и более молекул встречается редко. Траектория движения молекул ломаная линия.
 Если
Если 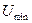 >>
>>  , то вещество находится в твердом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого
, то вещество находится в твердом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого  . В твердом состоянии молекулы и атомы сильно сцеплены друг с другом, вещество сохраняет форму и объем. При деформации возникают силы, стремящиеся восстановить форму и объем. Молекулы и атомы располагаются в строго определенных местах и образуют кристаллическую решетку. Молекулярное движение выглядит так, молекулы колеблются около некоторого положения равновесия, называемого узлом кристаллической решетки. Покидать область внутри узлов они, как правило, не могут. Линии, вдоль которых происходят колебания и амплитуда колебаний меняются с течением времени, но за большие, по сравнению с периодом колебаний промежутки времени. Вдоль фиксированной линии совершается достаточно много колебаний, прежде чем направление колебаний изменится. С учетом этого траекторию движения отдельной молекулы можно изобразить как последовательность линейных колебаний с различными амплитудами и в различных направлениях.
. В твердом состоянии молекулы и атомы сильно сцеплены друг с другом, вещество сохраняет форму и объем. При деформации возникают силы, стремящиеся восстановить форму и объем. Молекулы и атомы располагаются в строго определенных местах и образуют кристаллическую решетку. Молекулярное движение выглядит так, молекулы колеблются около некоторого положения равновесия, называемого узлом кристаллической решетки. Покидать область внутри узлов они, как правило, не могут. Линии, вдоль которых происходят колебания и амплитуда колебаний меняются с течением времени, но за большие, по сравнению с периодом колебаний промежутки времени. Вдоль фиксированной линии совершается достаточно много колебаний, прежде чем направление колебаний изменится. С учетом этого траекторию движения отдельной молекулы можно изобразить как последовательность линейных колебаний с различными амплитудами и в различных направлениях.
 Если
Если 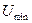

 , то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее
, то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее  . В жидком состоянии вещество стремится сохранить объем, но не сохраняет форму. Молекулы жидкости находятся близко друг от друга, как бы соприкасаясь, однако их положение не фиксировано, они сравнительно медленно меняют положение друг относительно друга. Траектория можно представить в виде непрерывной кривой. Иногда молекулы соединяются в агрегаты, состоящие из большого числа молекул. Причем, расположение молекул определенным образом упорядочено, в этом случае жидкости обладают некоторыми свойствами, характерными для твердых тел (т.н. жидкие кристаллы).
. В жидком состоянии вещество стремится сохранить объем, но не сохраняет форму. Молекулы жидкости находятся близко друг от друга, как бы соприкасаясь, однако их положение не фиксировано, они сравнительно медленно меняют положение друг относительно друга. Траектория можно представить в виде непрерывной кривой. Иногда молекулы соединяются в агрегаты, состоящие из большого числа молекул. Причем, расположение молекул определенным образом упорядочено, в этом случае жидкости обладают некоторыми свойствами, характерными для твердых тел (т.н. жидкие кристаллы).
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода из одного агрегатного состояния в другое зависит от значения 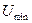 для данного вещества. Например, у инертных газов
для данного вещества. Например, у инертных газов 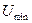 мало, а у металлов — велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
мало, а у металлов — велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2965; Нарушение авторских прав?; Мы поможем в написании вашей работы!