
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робоче тіло і термодинамічна система
|
|
|
|
Речовина, за допомогою якої перетворюється теплова енергія в механічну або навпаки називається робочим тілом.
Частина всесвіту, яка виділена для дослідження називається термодинамічною системою. Все що є за межами термодинамічної системи – довкілля або навколишнє середовище. Як правило термодинамічна система і довкілля розділені якоюсь поверхнею розділу при чому в технічній термодинаміці цій поверхні надають властивості розтягуватися чи звужуватися при чому на це розтягування чи звуження не вимагається ніякої енергії.
Класифікація термодинамічних систем:
а) за енергообміном:
– термічно ізольовані; або адіабатні (якщо система не може обмінюватися з довкіллям тепловою енергією)
– механічно ізольовані;(якщо система не може обмінюватися з довкіллям механічною енергією)
– повністю ізольовані.
б) за обміном робочим тілом:
– відкриті – обмінюються з навколишнім середовищем;
– закриті – не обмінюються з навколишнім середовищем.
в) за кількістю фаз в термодинамічній системі:
– гомогенні; – гетерогенні.
2.3. Основні термодинамічні параметри стану.
Параметри стану – величини, які характеризують якийсь стан системи. Технічна термодинаміка виділяє три основні параметри стану. Розглянемо їх.
1. Абсолютна температура – міра нагрітості тіла або міра інтенсивності хаотичного руху молекул газу і визначається середньою кінетичною енергією руху молекул газу.
Позначається абсолютна температура Т.
Коли 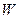 = 0 (швидкість руху молекул) то
= 0 (швидкість руху молекул) то 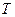 = 0. Тому завжди Т ≥ 0.
= 0. Тому завжди Т ≥ 0.
Найбільш універсальною є абсолютна термодинамічна шкала температур – шкала Кельвіна (намалювати). Вона має єдину реперну (опорну) точку t = 0,01 оС – температура трійної точки води (стан рівноваги льоду, води і пари). Їй приписується значення 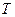 = 273,16 К. Різниця між шкалами Цельсія і Кельвіна 273,15 К. Отже T = t + 273,15.
= 273,16 К. Різниця між шкалами Цельсія і Кельвіна 273,15 К. Отже T = t + 273,15.
2. Абсолютний тиск.
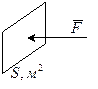 Розглянемо якусь посудину (намалювати) в середині якої знаходиться газ. Візьмемо стінку посудини – в результату хаотичних рухів молекул відбувається силова взаємодія стінки з молекулами – молекули безперервно б’ються об стінку посудини. Якщо узагальнити і взяти рівнодійну сили що діє на стінку позначивши її буквою
Розглянемо якусь посудину (намалювати) в середині якої знаходиться газ. Візьмемо стінку посудини – в результату хаотичних рухів молекул відбувається силова взаємодія стінки з молекулами – молекули безперервно б’ються об стінку посудини. Якщо узагальнити і взяти рівнодійну сили що діє на стінку позначивши її буквою 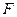 (це векторна величина), а площу поверхні стінки позначити буквою
(це векторна величина), а площу поверхні стінки позначити буквою 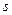 і віднести силу що діє по нормалі до цієї площі то ми отримаємо поняття абсолютного тиску який позначається малою буквою
і віднести силу що діє по нормалі до цієї площі то ми отримаємо поняття абсолютного тиску який позначається малою буквою 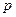 .
. 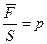 [Па]. Можна використовувати похідні кПа, МПа як правило вищими величинами тиску в термодинаміці не оперують.
[Па]. Можна використовувати похідні кПа, МПа як правило вищими величинами тиску в термодинаміці не оперують.
Важливо розрізняти тиск який має термодинамічна система і довкілля. Ось маємо посудину (термодинамічна система) з тиском p до якої під’єднаний U-подібний манометр. Друга вітка манометра сполучена з довкіллям тиск якого 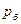 . Тиск довкілля вимірюється приладом – барометр. Розглянемо два варіанти відношення між тисками системи і довкілля – коли... і.... Тоді тут сила більша діє на рідину а тут менша. Стовпчики відповідно... Перепад позначимо
. Тиск довкілля вимірюється приладом – барометр. Розглянемо два варіанти відношення між тисками системи і довкілля – коли... і.... Тоді тут сила більша діє на рідину а тут менша. Стовпчики відповідно... Перепад позначимо 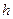 . Сума бар.та надл.тиску буде абсолютним
. Сума бар.та надл.тиску буде абсолютним

 , тоді як надлишковий тиск
, тоді як надлишковий тиск 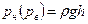 . Тоді тиск надлишковий, а прилад для вимірювання надлишкового тиску – манометр. Тому часто замість н пишуть букву м.
. Тоді тиск надлишковий, а прилад для вимірювання надлишкового тиску – манометр. Тому часто замість н пишуть букву м.
Отже для вимірювання абсолютного тиску системи необхідно мати два прилади – барометр і манометр (вакуумметр).
А у випадку коли 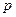 менший за
менший за 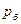 . Тоді абсолютний тиск визначається як різниця барометричного тиску і тиску вакууму.
. Тоді абсолютний тиск визначається як різниця барометричного тиску і тиску вакууму. 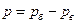 Вакуумметр.....
Вакуумметр.....
Використовуються і несистемні одиниці вимірювання тиску:
1 ат = 1 кгс/см2 = 9,81∙104 Па – технічна атмосфера; 1 атм = 10,133∙104 Па = 760 мм.рт.ст. - фізична атмосфера; 1 бар = 105 Па = 0,1 МПа; 1 мм.вод.ст. = 9,81 Па; 1 мм.рт.ст = 133,33 Па.
3. Об’єм (питомий об’єм).
V, м3 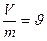
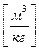 .
. 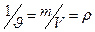
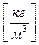 . Густину теж дозволяється використовувати в якості третього параметру стану.
. Густину теж дозволяється використовувати в якості третього параметру стану.
Отже в технічній термодинаміці використовуються три основні параметри стану: абсолютна температура, абсолютний тиск, об’єм (питомий об’єм, густина). Їх прийнято ділити на інтенсивні та екстенсивні. (бажано записати)
Екстенсивні – ті що підлягають правилу аддитивності (правило складання). Наприклад об’єм, маса 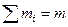 ,
, 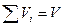 . Наприклад ми взяли система розділили на багато частинок і визначили об’єм кожної з них, а потім додали ці об’єми то ми отримали загальний об’єм робочого тіла. Так само маса.... Це є правило складальності (аддитивності).
. Наприклад ми взяли система розділили на багато частинок і визначили об’єм кожної з них, а потім додали ці об’єми то ми отримали загальний об’єм робочого тіла. Так само маса.... Це є правило складальності (аддитивності).
Інтенсивні – температура і тиск. Тому що сума температури і тиску кожної частинки тіла не дасть загальної температури і тиску.
Інтенсивні величини можуть бути рушійними силами процесу, а екстенсивні – ніколи не будуть.
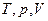 прийнято називати термічними параметрами стану.
прийнято називати термічними параметрами стану.
2.4 Рівняння стану робочого тіла.
Що стосується рівняння стану робочого тіла то тут треба мати дві сторони його – математичну і термодинамічну.
Якщо розглянемо функцію від основних параметрів стану 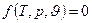 – з математичної точки зору це рівняння зв’язку між величинами параметрів стану.
– з математичної точки зору це рівняння зв’язку між величинами параметрів стану.
З термодинамічної точки зору: рівняння стану це таке рівняння яке описує всі стани робочого тіла при різних значеннях параметрів стану.
Рівняння стану – це рівняння якоїсь поверхні в трьохмірній системі координат.
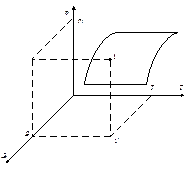 Термодинамічна поверхня – геометричне місце безлічі окремих станів робочого тіла.
Термодинамічна поверхня – геометричне місце безлічі окремих станів робочого тіла.
І зовсім інша справа коли взяти залежність одного параметру від інших. Тоді не потрібна просторова система координат. Тоді візьмемо систему двовимірну на площині і спростимо геометричну інтерпретацію рівняння:
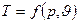 ;
; 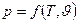 ;
; 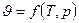 (навести схеми). Кожна точка в межах цієї діаграми (саме так називаються ці графіки) є окремим станом робочого тіла.
(навести схеми). Кожна точка в межах цієї діаграми (саме так називаються ці графіки) є окремим станом робочого тіла.
2.5. Поняття рівноважного термодинамічного процесу.
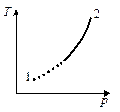 Берем якесь робоче тіло, беремо рівняння стану
Берем якесь робоче тіло, беремо рівняння стану 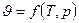 його стан визначає точка 1. Це означає що в будь-якій точці робочого тіла визначена температура буде одна і та ж....... абсолютний тиск буде один і той же. Тоді я маю право стверджувати що дане робоче тіло знаходиться в рівноважному стані.
його стан визначає точка 1. Це означає що в будь-якій точці робочого тіла визначена температура буде одна і та ж....... абсолютний тиск буде один і той же. Тоді я маю право стверджувати що дане робоче тіло знаходиться в рівноважному стані.
Якщо змінюється будь-який параметр 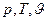 робочого тіла то відбувається термодинамічний процес. Стан робочого тіла є нерівноважним.
робочого тіла то відбувається термодинамічний процес. Стан робочого тіла є нерівноважним.
А от спробуємо перейти з одного рівноважного стану РТ т1 до іншого т2.
Сукупність нескінченно великого числа окремих рівноважних станів РТ дасть рівноважний термодинамічний процес.
Необхідно щоб 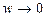 ,
, 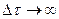 – це і є математична умова рівноважного термодинамічного процесу.
– це і є математична умова рівноважного термодинамічного процесу.
В реальних умовах цього немає – всі реальні процеси в тій чи інший мірі є нерівноважні.
1.6. Суміші ідеальних газів.
Ідеальним називається газ у якого:
– в якого відсутні сили міжмолекулярної взаємодії;
– об’єм молекули дорівнює нулю;
– маса молекули зосереджена в матеріальній точці.
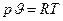 - ось рівняння Клапейрона. В цьому рівнянні
- ось рівняння Клапейрона. В цьому рівнянні 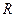 називається питома газова стала одиниця вимірювання
називається питома газова стала одиниця вимірювання 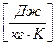 . Кожен газ має своє значення цієї сталої - наприклад
. Кожен газ має своє значення цієї сталої - наприклад
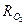 = 189
= 189 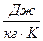 ;
; 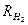 = 4124
= 4124 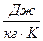 і т.д. В цьому рівнянні
і т.д. В цьому рівнянні 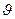 це питомий об’єм, а якщо помножити ліву і праву частини цього рівняння на
це питомий об’єм, а якщо помножити ліву і праву частини цього рівняння на 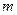 то
то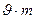 = V [м3] і рівняння набуде вигляду
= V [м3] і рівняння набуде вигляду 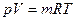 . Це те саме рівняння Клапейрона тільки тут перше для одного кілограма, а друге для
. Це те саме рівняння Клапейрона тільки тут перше для одного кілограма, а друге для 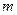 кг газу.
кг газу.
А Менделєєв це рівняння записав для 1 кмоля або для відповідної кількості кмоль. Якщо взяти масу газу 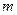 кг і поділити на
кг і поділити на 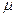 - молекулярна маса газу
- молекулярна маса газу 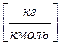 то ми отримаємо
то ми отримаємо 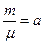 - число кіломолів; якщо об’єм газу поділити на число кіломолів то ми отримаємо
- число кіломолів; якщо об’єм газу поділити на число кіломолів то ми отримаємо 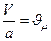 - молярний об’єм газу
- молярний об’єм газу 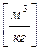 . Рівняння Менделєєва-Клапейрона записано для одного кіломоля газу
. Рівняння Менделєєва-Клапейрона записано для одного кіломоля газу 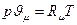 . Тут
. Тут 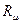 - універсальна газова стала. Чому універсальна тому, що вона одинакова для всіх газів. А чому вона рівна. Нормальні умови:
- універсальна газова стала. Чому універсальна тому, що вона одинакова для всіх газів. А чому вона рівна. Нормальні умови: 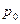 = 10,1325∙104 Па T0 = 273,15 К (0 оС). Можна взяти нормальні умови, а за законом Авогадро за нормальних умов кіломоль будь-якого газу займає сталий об’єм
= 10,1325∙104 Па T0 = 273,15 К (0 оС). Можна взяти нормальні умови, а за законом Авогадро за нормальних умов кіломоль будь-якого газу займає сталий об’єм 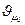 = 22,4
= 22,4 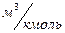 то підставивши ці дані в рівняння стану для одного кіломоля газу отримаємо, що універсальна газова стала
то підставивши ці дані в рівняння стану для одного кіломоля газу отримаємо, що універсальна газова стала 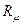 = 8314
= 8314 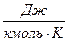 і ця величина одинакова для всіх газів. І це рівняння дає можливість легко знаходити питому газову сталу
і ця величина одинакова для всіх газів. І це рівняння дає можливість легко знаходити питому газову сталу 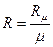
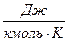 . Якщо помножити ліву і праву частини рівняння Менделєєва-Клапейрона на
. Якщо помножити ліву і праву частини рівняння Менделєєва-Клапейрона на 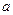 то рівняння набуде вигляду
то рівняння набуде вигляду 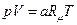 . Це теж рівняння М-К але для а кіломолів газу.
. Це теж рівняння М-К але для а кіломолів газу.
Суміші ідеальних газів. Ми розглянемо механічні суміші газів коли гази між собою хімічно не взаємодіють. Якщо взяти в посудину декілька газів то завдяки хаотичному руху молекул кожен газ буде рівномірно роззосереджений по цій посудині і утвориться суміш. Більше приходиться мати справу з сумішами ніж з чистим газом. Приклад: повітря, при чому для нього всі закони ідеального газу справджуються, продукти згоряння палива, природній газ що транспортується по газопроводах хоча в ньому переважає метан але це суміш.
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2451; Нарушение авторских прав?; Мы поможем в написании вашей работы!