
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні положення розрахунків суміші ідеальних газів
|
|
|
|
 Маємо таку посудину де знаходиться
Маємо таку посудину де знаходиться 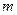 (кг) різних газів. Гази які входять до складу суміші називаються компонентами цієї суміші. Параметри суміші
(кг) різних газів. Гази які входять до складу суміші називаються компонентами цієї суміші. Параметри суміші 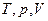 , маса суміші складається з мас кожного газу в суміші
, маса суміші складається з мас кожного газу в суміші  , де
, де 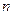 - кількість компонентів. І тут введемо поняття парціального тиску і об’єму.
- кількість компонентів. І тут введемо поняття парціального тиску і об’єму.
Тиск який створює кожен газ занаходячись в суміші називається його парціальним тиском. Як реально зафіксувати парціальний тиск. Ось в ящику є 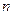 газів. Ми залишаємо в ньому якийсь один, решту видаляєм. І отримуємо цей перший газ при T, V: об’ємі і температурі суміші. І тоді абсолютний тиск який буде мати газ в посудині знаходячись один і буде його парціальним тиском. В 1801 році англійський вчений Дальтон сформулював закон для газової суміші, який носить його ім’я – закон Дальтона. Математично цей закон записується так: сума парціальних тисків всіх газів що входять до суміші дорівнює абсолютному тиску суміші
газів. Ми залишаємо в ньому якийсь один, решту видаляєм. І отримуємо цей перший газ при T, V: об’ємі і температурі суміші. І тоді абсолютний тиск який буде мати газ в посудині знаходячись один і буде його парціальним тиском. В 1801 році англійський вчений Дальтон сформулював закон для газової суміші, який носить його ім’я – закон Дальтона. Математично цей закон записується так: сума парціальних тисків всіх газів що входять до суміші дорівнює абсолютному тиску суміші 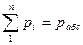 . Ми говоримо про суміш ідеальних газів тому цей закон справджується 100-відсотково для суміші ідеальних газів, а наприклад більшість реальних газів при фізичних тисках ведуть себе як ідеальні і тільки при збільшенні тисків є відхилення від закону. Парціальних тиск можна розрахувати з рівняння стану
. Ми говоримо про суміш ідеальних газів тому цей закон справджується 100-відсотково для суміші ідеальних газів, а наприклад більшість реальних газів при фізичних тисках ведуть себе як ідеальні і тільки при збільшенні тисків є відхилення від закону. Парціальних тиск можна розрахувати з рівняння стану 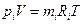 , береться якийсь і-й газ, цей газ займає об’єм суміші і має абсолютну температуру суміші і в рівняння підставляють його масу і його питому газову сталу. І з рівняння можна знайти парціальний тиск цього газу.
, береться якийсь і-й газ, цей газ займає об’єм суміші і має абсолютну температуру суміші і в рівняння підставляють його масу і його питому газову сталу. І з рівняння можна знайти парціальний тиск цього газу.
Поряд з поняттям парціального тиску існує поняття парціального об’єму. Якщо парціальний тиск це реальна річ тому що кожний газ рівномірно розподіляється по посудині і створює якийсь тиск на стінки. А парціальний об’єм річ уявна. Так само взяли один газ дали йому тиск суміші і температуру суміші, але якщо він один в посудині то він займе природно весь об’єм посудини то він буде мати парціальний тиск, а парціальний тиск менший від абсолютного тиску суміші. А щоб збільшити тиск до тиску суміші треба цей газ стиснути. І от той об’єм який він буде займати і називається парціальним. Є такий закон Амага, який аналогічний закону Дальтона що сума парціальних об’ємів газів в газовій суміші дорівнює об’єму газової суміші 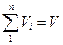 . Так само цей закон для суміші ідеальних газів, а для реальних він може не справджуватися. В ідеального газу об’єм молекули дорівнює нулю, його можна стиснути до безкінечності, а в реального молекули мають певний об’єм і стиснути його менше певної величини не можливо. Так само
. Так само цей закон для суміші ідеальних газів, а для реальних він може не справджуватися. В ідеального газу об’єм молекули дорівнює нулю, його можна стиснути до безкінечності, а в реального молекули мають певний об’єм і стиснути його менше певної величини не можливо. Так само 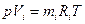 , де
, де 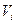 - парціальний об’єм.
- парціальний об’єм.
Одне з важливих положень для газової суміші, як задати склад газової суміші, як показати якого газу скільки є в суміші. Це треба зробити так щоб ці показники не були залежні від параметрів стану – щоб вони не змінювалися коли змінюються ці параметри. Склад газової суміші можна задати масовими частками, об’ємними частками та мольними (молярними) частками. Є маса суміші, є маси компонентів 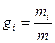 коли додати ці масові частки томи отримаємо
коли додати ці масові частки томи отримаємо 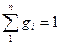 . Аналогічно
. Аналогічно  - об’ємна частка
- об’ємна частка  . Можна взяти і помножити праву і ліву частини рівняння на 100 і отримаємо у відсотках. Від маси кожного газу можна перейти до кількості газу в кіломолях і просумувавши ці величини отримати кількість суміші в кіломолях тоді
. Можна взяти і помножити праву і ліву частини рівняння на 100 і отримаємо у відсотках. Від маси кожного газу можна перейти до кількості газу в кіломолях і просумувавши ці величини отримати кількість суміші в кіломолях тоді 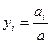 - мольна частка
- мольна частка  . Коли ми такими методами подаємо склад суміші то ці показники не залежать від параметрів стану суміші. Можна довести, що
. Коли ми такими методами подаємо склад суміші то ці показники не залежать від параметрів стану суміші. Можна довести, що  .
.
Треба вміти розрахувати середню або уявну молярну масу газової суміші. До газової суміші входять 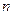 газів, а ми беремо ці
газів, а ми беремо ці 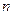 газів і замінюємо одним якимось газом з так званою середньою або уявною молекулярною масою. Вона розраховується за формулою через масові частки, або через об’ємні чи молярні частки
газів і замінюємо одним якимось газом з так званою середньою або уявною молекулярною масою. Вона розраховується за формулою через масові частки, або через об’ємні чи молярні частки 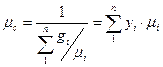 . А що нам дає ця молекулярна маса: вона дає можливість використовувати для розрахунків параметрів суміші рівняння Клапейрона, в якому треба знати питому газову сталу суміші і маючи середню молекулярну масу суміші можна розрахувати середню питому газову сталу суміші.
. А що нам дає ця молекулярна маса: вона дає можливість використовувати для розрахунків параметрів суміші рівняння Клапейрона, в якому треба знати питому газову сталу суміші і маючи середню молекулярну масу суміші можна розрахувати середню питому газову сталу суміші.  або
або  і дальше можна розрахувати будь-який параметр газової суміші, як для одного газу незалежно скільки газів є реально в суміші. Є формула яка зв’язує між собою масові і молекулярні або об’ємні частки
і дальше можна розрахувати будь-який параметр газової суміші, як для одного газу незалежно скільки газів є реально в суміші. Є формула яка зв’язує між собою масові і молекулярні або об’ємні частки  . Ця формула дозволяє маючи масовий склад суміші знайти його об’ємний або молярний склад.
. Ця формула дозволяє маючи масовий склад суміші знайти його об’ємний або молярний склад.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1820; Нарушение авторских прав?; Мы поможем в написании вашей работы!