
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перший закон термодинаміки
|
|
|
|
 Перший закон термодинаміки є не що інше як закон збереження і перетворення енергії. Згідно закону енергія не може бути ні створена, ні знищена, а може тільки перетворюватися з одного виду в інший в різних фізичних і хімічних процесах.
Перший закон термодинаміки є не що інше як закон збереження і перетворення енергії. Згідно закону енергія не може бути ні створена, ні знищена, а може тільки перетворюватися з одного виду в інший в різних фізичних і хімічних процесах.
Енергія ізольованої термодинамічної системи залишається незмінною незалежно від того які термодинамічні процеси в цій системі протікають.
Проілюструємо цей закон. Отже циліндр, поршень під яким знаходиться 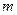 кг газу. Поршень навантажимо силою
кг газу. Поршень навантажимо силою 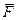 незмінного значення. Уявімо, що через стінку циліндра до даного газу ми підведемо або відведемо теплоту. Що відбудеться з газом. Він буде розширюватись що видно по переміщенню поршня. Буде змінюватися об’єм, а отже буде виконана робота. А якщо заміряти температуру газу то виявляється що вона виростає. Значить збільшується і вн.ен. цього газу. Отже складемо рівняння балансу енергії.
незмінного значення. Уявімо, що через стінку циліндра до даного газу ми підведемо або відведемо теплоту. Що відбудеться з газом. Він буде розширюватись що видно по переміщенню поршня. Буде змінюватися об’єм, а отже буде виконана робота. А якщо заміряти температуру газу то виявляється що вона виростає. Значить збільшується і вн.ен. цього газу. Отже складемо рівняння балансу енергії. 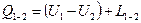 - рівняння балансу. Тому часто перший закон термодинаміки формулюють в технічній термодинаміці: Теплота підведена до робочого тіла витрачається на зміну внутрішньої енергії робочого тіла та на виконання роботи зміни об’єму цього тіла.
- рівняння балансу. Тому часто перший закон термодинаміки формулюють в технічній термодинаміці: Теплота підведена до робочого тіла витрачається на зміну внутрішньої енергії робочого тіла та на виконання роботи зміни об’єму цього тіла.
Зміна вн.ен. буде  ; а якщо прийняти що процес рівноважний то роботу зміни об’єму можна записати у вигляді інтегралу:
; а якщо прийняти що процес рівноважний то роботу зміни об’єму можна записати у вигляді інтегралу: 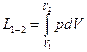 . Всі величини в рівняння подані для певної кількості газу
. Всі величини в рівняння подані для певної кількості газу 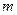 .
. 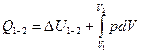 - це інтегральна форма запису закону. Якщо використати питомі величини то ця сама інтегральна форма запису виглядатиме так
- це інтегральна форма запису закону. Якщо використати питомі величини то ця сама інтегральна форма запису виглядатиме так 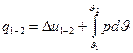 .
. 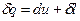 ;
; 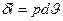 - диференціальна форма. Так як ентальпія є
- диференціальна форма. Так як ентальпія є 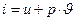 , а диференціал ентальпії є
, а диференціал ентальпії є 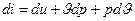 звідки
звідки 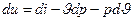 : тоді
: тоді 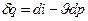 - диференціальна форма запису для 1 кг газу через ентальпію.
- диференціальна форма запису для 1 кг газу через ентальпію.
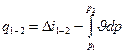 - інтегральна форма запису закону для 1 кг через ентальпію.
- інтегральна форма запису закону для 1 кг через ентальпію.
Правило знаків для теплоти узгоджене з правилом знаків для роботи. Теплота яка підводиться до робочого тіла завжди береться зі знаком „+”, а відводиться „–„.
2.5. Істина і середня теплоємність газів.
Визначення: Відношення елементарної кількості теплоти в нескінченно малому термодинамічному процесі до викликаної цим теплообміном зміни температури газу називається істинною теплоємністю газу в даному термодинамічному процесі.
Позначається істинна теплоємність С.
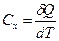 -. Відношення елементарної кількості теплоти
-. Відношення елементарної кількості теплоти 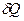 яка відведена чи підведена до газу до якоїсь нескінченно малої зміни температури
яка відведена чи підведена до газу до якоїсь нескінченно малої зміни температури  в даному термодинамічному процесі. Індекс
в даному термодинамічному процесі. Індекс 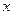 призваний розкрити особливість термодинамічного процесу, якщо якийсь основний параметр стану в процесі залишається незмінним то тоді пишуть наприклад
призваний розкрити особливість термодинамічного процесу, якщо якийсь основний параметр стану в процесі залишається незмінним то тоді пишуть наприклад 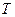 то
то 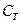 ,
, 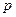 абсолютний тиск буде незмінним тоді
абсолютний тиск буде незмінним тоді 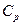 .
.
В реальних процесах може бути досить широкою зміна температури: від якогось початкового 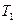 до кінцевого
до кінцевого 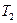 . Тоді аналогічно з істинною теплоємністю вводять поняття середньої теплоємності. Її позначають
. Тоді аналогічно з істинною теплоємністю вводять поняття середньої теплоємності. Її позначають 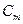 і вона є відношенням відповідної кількості теплоти
і вона є відношенням відповідної кількості теплоти 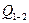 , отриманої або відданої робочим тілом, поділити на різницю температур
, отриманої або відданої робочим тілом, поділити на різницю температур 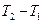 . Тут теж процес, який відбувається грає роль тому вводиться індекс
. Тут теж процес, який відбувається грає роль тому вводиться індекс 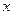 .
.
Середня теплоємність 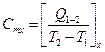 .
.
Для газів 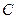 може змінюватись в діапазоні від
може змінюватись в діапазоні від 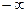 до
до  в залежності від того який процес має місце.
в залежності від того який процес має місце.
На практиці частіше використовують так звані питомі теплоємності: коли теплоємність віднести до одиниці кількості речовини то вона буде питомою теплоємністю. В залежності від кількості речовини розрізняють питомі теплоємності: питому масову теплоємність – 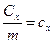 , одиниці вимірювання як для істинної так і для середньої
, одиниці вимірювання як для істинної так і для середньої 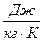 . Можна записувати як
. Можна записувати як 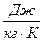 так і
так і 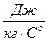 оскільки різниця
оскільки різниця 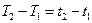 - від цього чисельне значення теплоємності не зміниться. Якщо віднесемо теплоємність до об’єму за нормальних умов ми отримаємо питому об’ємну питому теплоємність
- від цього чисельне значення теплоємності не зміниться. Якщо віднесемо теплоємність до об’єму за нормальних умов ми отримаємо питому об’ємну питому теплоємність  ,
,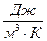 . І якщо ми теплоємність поділимо на кількість кіломолів
. І якщо ми теплоємність поділимо на кількість кіломолів 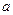 то ми отримаємо питому мольну теплоємність
то ми отримаємо питому мольну теплоємність  ,
,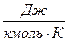 .
.
Питомі теплоємності між собою пов’язані: якщо 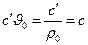 ; якщо ми
; якщо ми 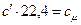 .
.
Теплоємність величина екстенсивна.
Використовуючи питомі теплоємності отримуємо зручні формули для розрахунку кількості теплоти.
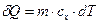 - формула для нескінченно малої кількості теплоти. Використовується масова теплоємність. Надалі частіше всього буде використовуватися якраз масова теплоємність...
- формула для нескінченно малої кількості теплоти. Використовується масова теплоємність. Надалі частіше всього буде використовуватися якраз масова теплоємність...
Якщо цю формулу проінтегрувати то ми отримаємо формулу для визначення кількості теплоти при зміні температур від Т1 до Т2 тобто через середню теплоємність 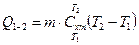 . Часто для середньої теплоємності не вказують інтервал для якого справедлива ця теплоємність.
. Часто для середньої теплоємності не вказують інтервал для якого справедлива ця теплоємність. 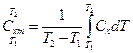 - формула зв’язку між істинною та середньою теплоємностями. Якщо температура газу змінюється незначно то без значної похибки використовується значення істинної теплоємності. А якщо зміна температури в процесі значна то користуються середньою теплоємністю.
- формула зв’язку між істинною та середньою теплоємностями. Якщо температура газу змінюється незначно то без значної похибки використовується значення істинної теплоємності. А якщо зміна температури в процесі значна то користуються середньою теплоємністю.
Теплоємність є функцією термодинамічного процесу. При переході від процесу до процесу той самий газ в одній і тій самій кількості підведеної теплоти має абсолютно різні значення теплоємності.
Теплоємності 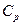 і
і 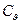 пов’язані між собою наступним рівнянням – для реального газу
пов’язані між собою наступним рівнянням – для реального газу 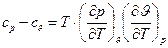 . Якщо ми візьмемо рівняння стану ідеального газу Клапейрона для одного кг
. Якщо ми візьмемо рівняння стану ідеального газу Клапейрона для одного кг 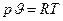 і з цього рівняння отримаємо частинні похідні
і з цього рівняння отримаємо частинні похідні 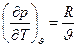 і
і 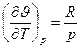 . Підставивши ці рівняння в залежність отримаємо
. Підставивши ці рівняння в залежність отримаємо 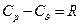 - рівняння Майєра для ідеального газу.
- рівняння Майєра для ідеального газу.
На практиці важливе значення має показник адіабати або коефіцієнт Пуассона 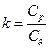 . Як уже вияснили що для ідеального газу завжди
. Як уже вияснили що для ідеального газу завжди 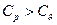 то
то  . Відомо що молекулярно-кінетична теорія встановлює значення теплоємності ідеального газу тільки в залежності від його атомності (ступенів свободи). В основі цієї теорії лежить закон про рівномірний розподіл внутрішньої енергії по ступеням свободи поступального та обертального руху молекул. Отримані на основі молекулярно-кінетичної теорії значення теплоємностей можна рекомендувати тільки для приблизних розрахунків. Ці значення наведені в таблиці.
. Відомо що молекулярно-кінетична теорія встановлює значення теплоємності ідеального газу тільки в залежності від його атомності (ступенів свободи). В основі цієї теорії лежить закон про рівномірний розподіл внутрішньої енергії по ступеням свободи поступального та обертального руху молекул. Отримані на основі молекулярно-кінетичної теорії значення теплоємностей можна рекомендувати тільки для приблизних розрахунків. Ці значення наведені в таблиці.
| Атомність газів | Теплоємність кДж/(кмоль∙К) | 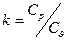
| |
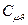
| 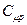
| ||
| Одноатомні Двоатомні Три і багатоатомні | 12,5 20,8 29,1 | 20,8 29,1 37,4 | 1,66 1,40 1,29 |
Для визначення масових ізобарної та ізохорної теплоємностей на основі молекулярно кінетичної теорії приймаються наступні рівняння 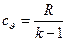 і
і 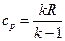 .
.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5422; Нарушение авторских прав?; Мы поможем в написании вашей работы!