
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Системой работы и приращение внутренней энергии
|
|
|
|
Теплота, полученная системой, расходуется на совершение
Теплота Q, полученная системой от среды – положительная, теплота, отданная системой в среду -- отрицательная. Работа А, совершенная самой системой против внешних сил - положительная, работа, совершенная над системой - отрицательная.
Существует и другая система записи (термохимическая):
DU = A + Q
Q >0, когда она выделятся из системы, А >0 когда она совершается системой.
У Блинова в пособии записана термодинамическая формулировка 1-го начала, а когда говорится о Q для реакции – принимается термохимический подход.
Есть еще одна тд функция – энтальпия H = U+pV
Q функцией состояния не является, но при некоторых условиях протекания тд процесса (хим реакции) она может приобретать свойства функции состояния. Эти условия - закрытая система при р или V–const. Вот в этом смысл закона Гесса.
При р постоянных Qр =DH
При V –const Qv =DU
Из закона Гесса есть несколько следствий, позволяющих манипулировать тепловыми эффектами реакций. Вам достаточно двух:
1) нулевое следствие, или закон Лавуазье-Лапласа – тепловой эффект прямой реакции равен тепловому эффекту обратной реакции, взятому с противоположным знаком
прямая реакция r1 aA+bB = dD+eE, Dr1H
и обратная реакция r2 dD+eE = aA+bB, Dr2H
Dr1H = – Dr2H
2) следствие про теплоты образования веществ:
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ.
DrH = S (nпрод · DfH прод) – S (nисх · DfH исх)
DrU = S (nпрод · DfU прод) – S (nисх · DfU исх)
aA+bB = dD+eE
DrH = (d · D f H D +e ·D f H E) - (a · D f H A + b · D f H B )
DrU = (d · D f U D +e ·D f U E) - (a · D f U A + b · D f U B )
Теплота образования - то количество теплоты, которое выделяется или поглощается при образовании 1 моля i-го вещества (атом, молекула, ион) из простых веществ, взятых в термодинамически устойчивом состоянии при рассматриваемых условиях (давлении и температуре)
3С (графит) + 4Н2 (г) +0,5 O2 (г) = 1 С3Н7ОН(т/ж/г)
(Т исходных веществ = Т продуктов! D f H - это Qр,T, D f U - это Q v,T , индекс f -от formation) Теплота образования простых веществ в тд устойчивом состоянии (Н2, Cl2, O2, S‑ромбическая, С-графит) при стандартных условиях принимается равной нулю.
В таблицах указаны только стандартные теплоты образования при Т=25ºС и давлении 1 атм, то есть D f Ho(298). Есть способы расчета тепловых эффектов реакций при Т, отличной от стандартной – при помощи теплоемкостей участников реакции. Но нам нужно запомнить, что для приблизительной оценки теплового эффекта реакции и вполне достаточно уравнения этой реакции и данных для стандартной температуры.
Первое начало тд не говорит нам ничего о направлении процесса. Ответ на этот вопрос дает 2 начало тд.
Строго говоря 2 начало позволяет определить, пойдет ли реакция самопроизвольно.
Самопроизвольные процессы происходят в системе без какого-либо вмешательства со стороны окружающей среды.
В изолированной системе могут протекать только самопроизвольные процессы. Протекание их завершается равновесным состоянием, из которого система не может выйти без сообщения ей энергии со стороны окружающей среды.
Несамопроизвольные процессы требуют для своего протекания затрат энергии (в виде теплоты или работы).
1) Клаузиус (1850) Никакая совокупность процессов не может сводиться только к передаче теплоты от холодного тела к горячему, тогда как передача теплоты от горячего тела к холодному может быть единственным результатом процесса.
2) Вильям Томсон = лорд Кельвин (1854) Никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процессов.
3) Оствальд. Невозможно создать вечный двигатель второго рода.
В.д. 2 рода - это машина, которая производила бы работу только за счет поглощения теплоты из окружающей среды, без передачи части теплоты холодильнику. При работе такой машины закон сохранения энергии не нарушается, но создать ее невозможно.
Второе начало указывает на неравнозначность двух способов передачи энергии - теплообмена и работы. Работу можно полностью превратить в теплоту, а теплоту в работу полностью - нет.
В свете только что услышанного возникает необходимость ввести новую тд функцию: энтропия - новая функция состояния
- переход системы из состояния 1 с внутренней энергией U1 в состояние 2 с внутренней энергией U2 может происходить различными путями, с передачей различных количеств теплоты и работы, лишь бы соблюдалось 1 начало. Однако, не все процессы равноценны, так как не все они самопроизвольно идут. Стало быть, у системы существует особая, ранее не рассматривавшаяся нами функция состояния, значение которой неодинаково для разных процессов, возможных с точки зрения 1 начала. Причем изменение ее связано с теплотой процесса.
2-е начало в математическом виде:
DS = Q обр /T
DS > Q необр /T
(dSоб р = 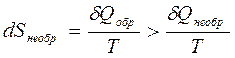 )
)
Размерность энтропии - Дж/К
После протекания необратимого процессов систему и окружающую среду нельзя одновременно вернуть в исходное состояние. Систему можно вернуть к исходному состоянию, но в окружающей среде при этом останутся "следы" необратимого процесса (например, изменится энергия тел окружающей среды).
После протекания обратимого процессов и систему, и среду можно вернуть в исходное состояние в результате обратного процесса. При этом в обратном процессе система пройдет в обратном порядке все те же промежуточные состояния, что и в прямом процессе.
Сделать расчет изменения энтропии процесса можно только по теплоте обратимого процесса!
Энтропия как мера беспорядка формула Больцмана S = k lnW
k - постоянная Больцмана, равна R/число Авогадро, W - термодинамическая вероятность для системы, то есть число микросостояний (варианты расположения молекул), отвечающих данному макросостоянию системы.
Существуют способы расчета DS для различных процессов - смешения газов, нагревания вещества, сжимания или расширения газов, фазового перехода вещества (плавление, испарение).
Определить S вещества можно на основе постулата Планка, тесно связанного с третьим началом термодинамики. Постулат Планка: энтропия идеального кристаллического тела при температуре 0 К равна 0. Таким образом, можно рассчитать S вещества, прибавив к 0 те DS, которые соответствуют процессам нагревания и фазовых переходов вещества при достижении им температуры от 0К до интересующей нас Т (например комнатной).
В изолированной системе могут идти только самопроизвольные процессы, и энтропия может только расти. (Q = 0, значит DS ≥ 0). Вот нам первый критерий направления самопроизвольного протекания процесса.
Для закрытых систем пользуются другими критериями с другими тд функциями:
G = U + pV –TS - энергия Гиббса, свободная энтальпия, изобарно-изотермический потенциал F = U –TS - энергия Гельмгольца, свободная энергия, изохорно-изотермический потенциал
Для самопроизвольного процесса DG≤ 0 или DF ≤ 0
Для реакции можно вычислить DG через DfG участников реакции по тому же правилу, что и для тепловых эффектов реакции:
DrG = S (nпрод · DfG прод) – S (nисх · DfG исх)
В таблицах даны D f G 0(298) для стандартных условий.(Важно помнить, что кроме давления и температуры в стандартные условия входит еще и стандартная концентрация – 1 моль/л для растворов, а для газов давление для каждого участника реакции – по 1 атм).
При T- const можно записать очень известную формулу: DG = DH –TDS
Она позволяет давать приблизительную оценку DrG при температурах, отличных от стандартной, т.к. DH реакции меняется не сильно, и DS тоже, значит, подставлять надо только Т.
Важно помнить, что если DrG >0, это не означает, что она не может протекать вообще. Она не может идти самопроизвольно, без сообщения системе энергии со стороны окружающей среды.
Еще одно важное уравнение: изотерма химической реакции для двусторонней реакции в системе
реакция между идеальными газами
(двусторонняя или обратимая реакция – одновременно идет прямая и обратная реакция, в состоянии равновесия скорости этих реакций равны)
a A+ b B ↔ d D+ e E
DGp,T = RTln 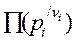 - RTlnKp
- RTlnKp
где 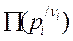 =
=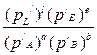 .
.
Кр можно определить через равновесные давления: когда система в равновесии, то DG = 0, тогда
Kp = 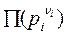 =
=
р без штрихов - равновесные давления реагирующих ид газов,
p/ начальные давления (до того, как реакции начали идти).
Для системы, где реакция идет в идеальных растворах, вместо давлений p подставляем молярные концентрации C и используем Kc.
Можно составить и уравнение для системы, где есть и растворы и газы. Там учитываются и С и р, а константа равновесия в уравнении смешанная.
Для реальноых газов вместо давления подставляют f - фугитивность.
Для реальных растворов вместо концентрации подставляют а – активность.
Вопросы определения активности и фугитивности в программу не входят.
Наконец, критерий самопроизвольного процесса для двусторонней реакции (в газовой фазе) через константы равновесия:
а) Пр/ < Кр тогда DGp,T < 0
Самопроизвольный необратимый процесс. Реакция пойдет слева направо.
б) Пр/ > Кр тогда DGp,T > 0
Это процесс несамопроизвольный необратимый, то есть реакция пойдет справа налево.
в) Пр/ = Кр тогда DGp,T = 0
Реакция достигла состояния равновесия
Двусторонняя реакция рано или поздно достигает состояния равновесия, когда скорость прямой реакции равна скорости обратной реакции, и
концентрации участников реакции держатся постоянными. Именно эти равновесные концентрации входят в константу равновесия. Хотелось бы знать, как константа реакции меняется при изменении условий протекания реакции. Для приблизительной оценки годится принцип ЛеШателье-Брауна:
Если на систему, которая находится в равновесии, оказывается воздействие, то равновесие в системе сместится так, чтобы компенсировать это воздействие.
|
|
|
Дата добавления: 2014-01-05; Просмотров: 630; Нарушение авторских прав?; Мы поможем в написании вашей работы!