
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимия. Электрохимия - изучает физико-химические свойства ионных систем, а также явления и процессы на границе раздела фаз с учетом зараженных частиц (электронов и
|
|
|
|
Электрохимия - изучает физико-химические свойства ионных систем, а также явления и процессы на границе раздела фаз с учетом зараженных частиц (электронов и ионов).
Электролиты – хим. соединения, которые диссоциируют (распадаются) на ионы (полностью или частично) в растворе или в расплаве.
Реально в растворе идет параллельно диссоциация молекул на ионы и ассоциация ионов в молекулы. Устанавливаются некоторые равновесные концентрации всех компонентов, которая характеризуется параметром a.
Степень диссоциации a - отношение числа продиссоциировавших молекул к числу всех первоначально взятых молекул.
Сильные электролиты диссоциируют практически полностью, a = 1. В водных растворах это некоторые неорг. основания и кислоты, большинство неорг. и орг. солей.
Слабые электролиты диссоциируют только частично, a<1. В водных растворах это почти все органические кислоты и основания, некоторые неорг. соединения.
Доказано, что "сила" электролита зависит от природы растворителя - вещество в одном растворителе м.б. сильным электролитом, в другом -слабым.
Есть еще один важный параметр - константа диссоциации Кдисс.
Пусть мы имеем раствор электролита МА с молярной концентрацией С.
 М А M+ + A- (это так называемый бинарный 1-1 зарядный электролит)
М А M+ + A- (это так называемый бинарный 1-1 зарядный электролит)
Тогда константа диссоциации К дисс = 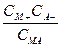
причем концентрации в уравнении указаны те, которые устанавливаются в растворе при равновесии для ионов и недиссоциировавших молекул. То есть СМА 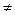 С.
С.
СА+ = a*С, СМ+ = a С, СМА = С (1- a),
a зависит от природы растворителя (примерно - чем выше диэлектрическая проницаемость растворителя, тем больше a), температуры, присутствия других электролитов в р-ре, концентрации электролита.
К дисс от концентрации не зависит до 0,2М, после она немного меняется. Это концентрационная константа диссоциации.
Термодинамическая константа равновесия Кºдисс зависит только от T. В ней вместо молярных концентраций компонентов (С) подставлены активности компонентов (a).
Активность – это как бы условная концентрация, учитывающая, что не все молекулы вступают в реакции, некоторая их часть «отвлекается» на взаимодействие друг с другом и растворителем, поэтому С ≠ a. Обычно С > a, в очень разбавленных растворах С ≈ a, так что в курсе химии для не-химиков в уравнениях, где нужно писать a, пишут C и про активность ничего и не рассказывают.
Первая количественная теория эл. диссоциации создана Аррениусом - его докторская дисс.(1883-1887). Она хорошо объясняла многие свойства растворов слабых электролитов при невысоких концентрациях. Но концентрированные растворы слабых электролитов и растворы сильных электролитов в его схему не укладывались. Например, нельзя было объяснить, почему Кдисс зависит от концентрации раствора (активность придумали позднее J)
Еще теория Аррениуса не объясняла, почему в ряде случаев a > 1.
Теория не раскрывала причины, вызывающие диссоциацию (например, взаимодействие ионов с растворителем вообще не рассматривалось, считалось, что ионы просто механически распределены между молекулами растворителя).
Объяснение этому дала теория Дебая-Хюккеля, о которой в этом курсе не рассказывается.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 302; Нарушение авторских прав?; Мы поможем в написании вашей работы!