
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические системы
|
|
|
|
Расчет рН растворов
Пример: рассчитайте рН в растворе 0,2М NaOH при 250C.
Решение. Сильный 1-1 зарядный электролит (щелочь) дает 0,2М ОН- ионов (будем считать, что он диссоциирует полностью, коэффициента активности искать не будем в таблицах). Вода тоже диссоциирует, давая в равных количествах Н+ и ОН- ионы.
Поэтому СOH- = 0,2 + СH+ =0,2+10-7 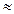 0,2 рОН= - lg0.2
0,2 рОН= - lg0.2 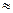 0.7
0.7
Различают два типа электрохимических систем:
1) электролизер (- источник тока внешний)
электролиз - совокупность процессов эл-хим окисления и восстановления, происходящих на погруженных в раствор электролита электродах при прохождении эл. тока.
2) гальванический элемент (=химический источник тока) –
электроэнергия вырабатывается в результате прямого преобразования хим. энергии окислительно-восстановительных реакций.
Для 1) и 2) на а ноде идет реакция о кисления, на к атоде - реакция в осстановления.
Заряд электродов:
1) анод +, катод -
2) анод - о тр, катод + п оложит
Про элемент Даниэля-Якоби, стандартную водородную шкалу электродных потенциалов почитайте самостоятельно. Обратите внимание на то, какие реакции идут на каждом электроде гальванического элемента, и как записывается реакция во всем гальваническом элементе. Помните, что реакции на электродах идут всегда в обоих направлениях, но какое-то направление преобладает.
В самостоятельной работе будет задание на составление гальванического элемента из заданных электродов и вычисление его ЭДС.
В гальваническом элементе происходят самопроизвольно реакции окисления и восстановления, связанные с перемещением заряженных частиц.
Потенциал электрода e (обозначения в других изданиях - Е, f) в элементе определяется по уравнению Нернста:
Сначала запишем реакцию восстановления вещества на электроде в общем виде:
аА + вВ + ze < = > lL + eE
e = e0 + 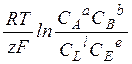 (Это ур-е Нернста. В числителе концентрации исходных
(Это ур-е Нернста. В числителе концентрации исходных
веществ в степенях, равных стехиометрическим
коэффициентам, в знаменателе то же для продуктов)
e0 - это станд. элд. потенциал, кот. устанавливается при всех С =1 или дроби =1 (в других книгах его обозначают как Е0, или как f0 , значение берется из таблицы).
z - число электронов, участвующих в реакции
R = 8.314 Дж/(моль·K) – универсальная газовая постоянная
F = 96500 Кл - число Фарадея, заряд в кулонах 1 моля электронов.
Более точно было бы в уравнение Нернста вместо C подставлять а (активность).
Например, реакция на хлоридсеребряном электроде записывается так
AgCl + e = Ag + Cl-
e = e0 + RT/(1·F)ln(CAgCl/(CAg ·C Cl-)).
Поскольку AgCl и Ag – вещества твердые с постоянными концентрациями, то есть их можно включить в значение константы e0, и тогда имеет значение только концентрация ионов Cl- в растворе.
Электродная реакция в общем виде может выглядеть и попроще (с меньшим числом компонентов):
Ox + z e = Red
(окисленная форма вещества Ox плюс z электронов превращается в восстановленную форму того же вещества Red)
Например
Zn2+ + 2 e = Zn0
Se0 + 2 e = Se2-
Для нее уравнение Нернста записывается так: e0 = e0 + RT/(zF) ln (CОx/CRed)
В гальваническом элементе, составленном из двух электродов, катодом (где идет реакция восстановления) будет тот, потенциал которого больше. Другой электрод будет анодом.
ЭДС гальванического элемента вычисляется как разность потенциалов катода и анода.
Стандартные электродные потенциалы приведены в таблицах. По ним можно судить не только о том, какой из электродов будет катодом, какой анодом, но и вообще о том, как будут вести себя вещества в окислительно- восстановительных реакциях.
Чем выше стандартный электродный потенциал для вещества, тем слабее восстановительная способность (способность отдавать электроны) металла (или Red) и тем сильнее окислительная способность (способность брать электроны) его иона (или Ox).

|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 467; Нарушение авторских прав?; Мы поможем в написании вашей работы!