
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №4
«Лекарственные средства на основе элементов VI группы ПСЭ»
Элементы - О, S, Sе, Те, Рb. На последнем энергетическом уровне 6 электронов, до завершения энергетического уровня не хватает 2 электронов, поэтому они способны принимать электроны, являются окислителями.
Кислород (О2) – самый сильный окислитель после фтора, способен существовать в виде 2-х аллотропных модификаций: О2 и О3. В медицинской практике широко применяется кислород и его водородные соединения: Н2О и Н2О2.
Н2О (Aqua) – существенная часть растительного и животного происхождения. Человеческий организм на 70% состоит из воды. В фармацевтической промышленности используют только очищенную дистиллированную воду. Дистиллированная вода используется как растворитель. Она должна отвечать требованиям Государственной фармакопеи: должна быть прозрачной, не иметь вкуса, запаха, рН 5,0-6,8, ρ = 1 г/мл. В ГФ включены 3 типы воды:
1) вода очищенная (Aqua purifiata);
2) вода для инъекций (Water – for Injections);
3) вода для инъекций в ампулах.
Воду очищенную получают метод дистилляции, ионным обменом, обратного осмоса. Для приготовления неинъекционных лекарственных средств используют свежеприготовленную воду. Хранят в закрытой емкости, предохраняя от инородных частиц и микробных загрязнений. Воду очищенную подвергают испытаниям: обязательно измеряют кислотность среды, сухой остаток не должен превышать 0,001% при выпаривании 100 мл воды.
Наличие восстановительных свойств определяют кипячением 100 мл очищенной воды с 1 мл 0,1% раствора перманганата калия (должно сохранятся розовое окрашивание). СО2 определяют путем смешивания равных объемов анализируемого раствора и известковой воды. В течение 2-х часов не должно проявится помутнение. NО2- и NО3- определяют реакцией с дифениламином в концентрированной серной кислоте. Не должен появиться голубой окрас. Для анализа берут 5 мл очищенной воды и добавляют 1 мл дифениламина. Анионы Cl-, SO42-, соли Са определяют в соответствии с требованиями ГФ. Содержание NН4+ не должно превышать 0,00002 г (определяют реактивом Несслера). Контроль на микробиологическую частоту проводят также как у питьевой воды: в 1 мл очищенной воды не более 3-х бактерий группы кишечной палочки.
Вода очищенная готовиться в соответствии с приказом № 96 «О контроле качества лекарственных средств изготавливающихся в аптеках».
Вода очищенная для инъекций должна отвечать всем вышеуказанным свойствам и не должна содержать других добавок. Ее подвергают испытаниям на механические включения (ГФ, ХI, стр.183). Испытывают свежеприготовленную и хранят при температуре от 5-100С не более суток. В условиях аптеки воду для инъекций подвергают контролю ежедневно (на содержание Cl-, SО4-2, Са+2). Воду для инъекций испытывают на восстановительные свойства, наличие аммиака и СО2. Один раз в квартал вода очищенная для инъекций направляется в контрольно-аналитическую лабораторию для полного химического анализа.
Вода очищенная для инъекций в ампулах. Ампулы выпускаются из нейтрального стекла на 1, 2, 3, 5, 10, 20 мл, которые стерилизуются при температуре 1200С в течение 20 минут. Этой воде предъявляют более строгие требования (на стерильность) (ГФ XI, стр.187). Срок хранения воды в ампулах для инъекций 4 года.
Н2О2 – Hydrogenium peroxydatum (вода окисленная).
Получение:
Н2SО4 + ВаО2 → Н2О2 + ВаSО4↓
MgО2 + 2 НCl → Н2О2 + MgCl2
В настоящее время Н2О2 получают аутокислением производных алкилантрагидрохинона:
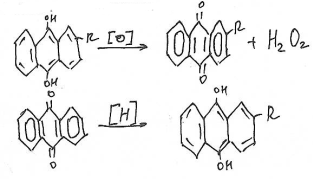
Гидроперид – смесь мочевины и Н2О2.
NН2 NН2
/ /
С = О + Н2О2 → С = О * Н2О2
\ \
NН2 NН2
Н2О2 – слабая кислота, проявляющая окислительно-восстановительные свойства, но восстановительные в большей степени. В чистом состоянии Н2О2 устойчива. Под воздействием света Н2О2 разлагается с выделением О2.
t
2 Н2О2 → 2 Н2О + О2↑
Подлинность:
2 КMnО4 + 5 Н2О2 + 3 Н3SО4 → 2 MnSО4 + К2SО4 + 5 О2↑ + 8 Н2О
Н2SО4 + К2Cr2О7 → Н2Cr2О7 + К2SО4
Н2О2 + Н2Cr2О7 → НО – Cr – О – Cr – ОН
// \\ // \\
О О О О
светло-зеленое окрашивание
Доброкачественность:
Государственная фармакопея разрешает содержание небольшого количества Mg2+, который определяется Na2НРо4:
Mg2+ + Na2НРо4 + NН3 → NН4 MgРо4 ↓ + 2 NaCl
белый кристаллический
Содержание мочевины определяется биуретовой реакцией (фиолетовая окраска).
Количественное определение:
Проводят методом оксидиметрии, точнее перманганатометрией.
2 КMnО4 + 5 Н2О2 + 3 Н3SО4 → 2 MnSО4 + К2SО4 + 5 О2↑ + 8 Н2О
Гидроперит можно определить методом йодометрии.
Хранение:
Хранят Н2О2 в стеклянных банках с притертой пробкой в защищенном от света месте. Твердые соединения перекиси хранят в сухом, защищенном от света месте в хорошо укупоренной таре. В соответствии с требованиями ГФ раствор перекиси водорода должен содержать на каждые 10 г Н2О2 0,05 г бензоата Na (стабилизатор).
Применение:
Как антисептическое, дезинфицирующее средство для промываний, полосканий. Используют в виде 0,25% раствора полученного из 3%. 1 таблетка гидроперита растворенного в 15 мл воды равна 3% раствору Н2О2. 1 таблетка гидроперита растворенного в 200 мл – соответствует 0,25% раствору Н2О2.
Сера (S) – широко встречается в природе в свободном состоянии и в виде минералов. Существует в виде нескольких аллотропных модификаций: ромбическая, моноциклическая. Эти два вида устойчивы.
Сера – твердое вещество с температурой плавления 114-1190С. Нерастворима в воде. По химическим свойствам типичный неметалл. Взаимодействует с простыми и сложными веществами. В медицинской практике используют серу очищенную.
Серу очищенную получают из серного цвета (самородная руда). Серу тщательно промывают водой, сушат, просеивают
4 S + 4 NН3 •Н2О → (NН4)2S2О3 + 2 NН4НS + Н2О
4 As2S5 + 24 NН3 •Н2О → 3 (NН4)3AsО4 + 5 (NН4)3AsS4 + 12 Н2О
(NН4)2S2О3 + 2 НNО3 → (NН4)2SО4 + S↓ + 2 NО2↑ + Н2О
Сера осажденную получают, тщательно измельчая серу очищенную на коллоидной мельнице в присутствии гидроксидов щелочных металлов.
4 S + 6 NaОН → Na2S3О3 + 2 Na2S↓ + 3 Н2О
затем подкисляют раствором НCl.
Подлинность серы:
- Определяют по запаху SО2, который образуется при сгорании и характерной синей окраски пламени.
S + О2 → SО2
- Раствор серы в горячем пиридине при добавлении нескольких капель гидрокарбоната натрия окрашивает серы в голубой или зеленый цвет при кипячении.

 t
t
S + + NaНСО3 → синий или зеленый цвет
 |
N
Доброкачественность:
Подвергается испытаниям на наличие мышьяка, селена.
Количественное определение:
Проводят, растворяя препарат в 0,5 М раствора спиртового КОН. Спирт отгоняют и добавляют 30% Н2О2.
12 S + 6 КОН → 2 К2S5 + К2S2О3 + 3 Н2О
К2 S2О3 + 2 КОН + 4 Н2О2 → 2 К2 SО4 + 5 Н2О
Избыток КОН оттитровывают 0,5 М раствором НCl.
КОН + НCl → КCl + Н2О
Хранение:
Хранят по простому списку, в сухом месте в хорошо укупоренных банках.
Применение:
Наружно в виде мазей (5, 10, 20%) и в виде присыпок при лечении кожных заболеваний: себореи, сикозе, чесотке. Ее действие основано на взаимодействии с органическими веществами. Образуются сульфиды и пентадиовая кислота, которая проявляет противомикробную активность.
Na2S2О3 – тиосульфат натрия.
Na2S2О3 . 5 Н2О Natrii tiosulfas – белое кристаллическое вещество, без запаха, хорошо растворим во всех растворителях.
Получение:
Из Na2S, из СаS (сульфида Са), полисульфида путем окисления:
- 2 Na2S + 2 SО2 → Na2S2О3 + S↓
СаS + 3 О2 → 2 СаS2О3
СаS2О3 + Na2SО4 → СаSО4↓ + Na2S2О3
- В промышленности: из отходов газового производства.
Na2S2О3 → соль тиосернистой кислоты
Na – О О
\ //
S6+
/ \\
Na – S2- О соединение непрочное, поэтому легко разлагается под действием слабых кислот
Na2S2О3 + СО2 + Н2О → Na2СО3 + S↓ + SО2↑ + Н2О
Подлинность:
По выделению SО2 можно идентифицировать тиосульфат:
- Na2S2О3 + 2 НCl → 2 NaCl + SО2↑ + S↓ + Н2О
помутнение раствора
- Na2S2О3 + AgNО3 → Ag2S2О3↓ + 2 NaNО3
белый
Ag2S2О3 → Ag2SО3 + S↓
Ag2SО3 + S + Н2О → Ag2S↓ + Н2SО4
черный
Потемнение раствора идет по времени. Если это наблюдается сразу, то говорит о загрязнении раствора сульфидом натрия. ГФ допускает наличие примесей ионов хлора, солей тяжелых металлов, но не допускает содержание ионов S-2, SО32-, SО42-, СО32-, солей Са+2.
Количественное определение:
Определяют методом йодометрии:
J2 + 2 Na2S2О3 → 2 NaJ + Na2S4О6
Применение:
1) При отравлении цианидами:
[H]
КСN + Na2S2О3 → КSСN + Na2SО3
Роданид менее ядовит, чем цианид.
2) При лечении аллергических заболеваний.
3) При лечении чесотки, так как SО2 обладает высоким противопаразитарным действием, в следствии прекращается зуд и чесоточный клещ погибает.
Хранение:
Хранят по простому списку, в прохладном месте, в хорошо укупоренных склянках, темного цвета, предохраняя от выветривания раствора.
Глауберова соль Na2SО4 . 10 Н2О.
Natrii sulfas – кристаллическая белая соль без запаха, хорошо растворима в воде.
Получение:
Na2СО3 + Н2SО4 → Na2SО4 + СО2↑ + Н2О
Соль образована сильным основанием и сильной кислотой. В спирте плохо растворима, при повышении температуры плавится.
Подлинность:
По катиону Na и аниону SО42-.
Na2SО4 + ВаCl2 → ВаSО4↓ + 2 NaCl
Na2SО4 + К2Н2Sb2О7 → Na2Н2Sb2О7 + К2SО4
Доброкачественность:
В препарате не должно быть аммиачных солей, содержание которых обнаруживается выделением аммиака, после нагревании с КОН.
 (NН4)2SО4 + 2 КОН → К2 SО4 + 2 NН4ОН
(NН4)2SО4 + 2 КОН → К2 SО4 + 2 NН4ОН

2 NН3 2 Н2О
Количественное определение:
Либо гравиометрическим (весовым путем с ВаCl2), либо хроматографическим методом с применением ионно-обменных смол.
RН+ + Na2SО4 → 2 R – Na + Na2SО4
Применяется как слабительное средство 15-30 г на прием при отравлении солями свинца.
Хранят в хорошо укупоренных банках в прохладном месте, предохраняя от выветривания.
Вопросы:
- Перечислите фармакопейные средства, содержащие элементы VI группы.
- Какие типы воды применяют в фармации?
- Реакции подлинности воды окисленной.
- Назовите соединения серы, применяемые в медицине.
- Как можно различить (реакция) сульфат Na и тиосульфат Na?
|
Дата добавления: 2014-01-05; Просмотров: 1604; Нарушение авторских прав?; Мы поможем в написании вашей работы!