
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №7
|
|
|
|
«Лекарственные средства на основе элементов II группы ПСЭ»
Ко 2 группе периодической системы относятся лекарственные средства главной подгруппы Ве+2, Мg+2, Са+2; побочной – Zn2+, Ba2+, Hg2+. Все вышеперечисленные элементы относятся к s- и d- элементам. На внешнем энергетическом уровне у них находятся 1-2 электрона. По химическим свойствам они являются типичными металлами, то есть обладают сильными восстановительными свойствами и играют большую роль в жизни организмов, соединения данных элементов находят широкое применение в медицине, фармации.
Магний (Мg) – содержится в земной коре 2,35%. Входит в состав доломита МgСО3 • ССО3, магнезита (карбоната Мg) 3 МgО • 4 SiО2 • 2 Н2О. Входит в состав хлорофилла. Содержание его в организме человека 0,04%. Входит в состав костной ткани, внутриклеточной жидкости, образует комплекс соединений с нуклеиновыми кислотами. Оказывает влияние на передачу нервного импульса, сократительную способность мышц, участвует в фосфорно-углеводном обмене, синтезе белка, способствует снижению АД, угнетает сосудистый и дыхательный центры. Содержится в абрикосе, персике, помидорах.
МgSО4 – Magnesii sulfas – белые призматические кристаллы, хорошо растворимы в воде, спирте.
Получение:
 Н2О
Н2О
 МgСО3 + Н2SО4 → МgSО4 + Н2СО3
МgСО3 + Н2SО4 → МgSО4 + Н2СО3
СО2
МgSО4 * 7 Н2О
Установление подлинности:
МgSО4 + Nа2НРо4 → МgНРо4↓ + Nа2SО4
белый растворимый
в минеральных
кислотах и СН3СООН
МgSО4 + 2 NаОН → Мg(ОН)2↓ + Nа2SО4 белый осадок
МgSО4 + (NН4)2СО3 → МgСО3↓ + (NН4)2SО4 белый осадок
МgSО4 + (NН4)2С2О4 → МgС2О4↓ + (NН4)2SО4
белый
осадок
МgSО4 + ВаCl2 → МgCl2 + ВаSО4↓
белый нерастворимый осадок
МgSО4 + 2 АgNО3 → Мg(NО3)2 + Аg2SО4↓
белый растворимый в кислотах осадок
Количественное определение:
- Гравиметрический метод – основан на взвешивании выделенного ВаSО4↓
МgSО4 + ВаCl2 → ВаSО4↓ + МgCl2
выделяется ВаSО4, промывается водой и высушивается до постоянной массы.
- Метод комплексонометрии (трилонометрии):
СН2СООН СН2СООН
\ /
N – СН2 – СН2 – N
/ \
СН2 СН2 + МgSО4 →
\ /
С = О С = О
\ /
O O
/ \
Nа Nа
СН2СООН СН2СООН
\ /
 → N – СН2 – СН2 – N
→ N – СН2 – СН2 – N
/ \
СН2 СН2 + NаSО4
/ \
С = О С = О
\ /
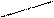
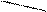 O O
O O
 Мg
Мg
Применение:
Применяют МgSО4 в качестве слабительного, как успокаивающее, при достаточно высокой концентрации наступает снотворный эффект, при высокой концентрации от 15% и выше – наркотический эффект, как спазмолитическое средство при гипертонической болезни. Также как противосудорожное средство, для обезболивания родов. Если ω ↑ 20%, то МgSО4 проявляет желчегонное действие.
Хранение:
Хранят в хорошо укупоренной таре, в проветриваемом помещении, предохраняя от влаги, по простому списку.
Са+ - содержание в природе ≈ 3,25%. В организме человека ≈ 2% от массы тела. В природе встречается в виде карбонатов, в виде фосфорита и плавикового шпата СаF2. Играет важную роль в жизнедеятельности организма: находится в костной ткани, в составе эритроцитов, лейкоцитов, сыворотке крови. Способствует сокращению мышц сердца, жизнедеятельности клеток, влияет на свертываемость крови, функцию эндокринных желез, оказывает противовоспалительное, противоаллергическое действие, влияет на функциональное состояние ЦНС и передачу нервных импульсов.
СаCl2 – Calcii chloridum – белый порошок без запаха, плохо растворимый в воде, спирте.
Получение:
Используют кальция карбонат, который встречается в большом количестве:
 СО2↑
СО2↑
 СаСО3 + 2 НCl → СаCl2 + Н2СО3
СаСО3 + 2 НCl → СаCl2 + Н2СО3
Н2О
Установление подлинности:
(NН4)2С2О4 + СаCl2 → СаС2О4↓ + 2 NН4Cl осадок белого цвета
СаCl2 + Н2SО4 → СаSО4↓ + 2 НCl осадок белого цвета
СаCl2 + Nа2НРО4 + NН4ОН → Са3(Ро4)2↓ + 2 NН4Cl + 4 NаCl + 2 Н2О осадок
белого цвета
СаCl2 + 2 АgNО3 → 2 АgCl↓ + Са(NО3-2)2
белый осадок
Количественное определение:
Метод комплексонометрии:
СН2СООН СН2СООН
\ /
N – СН2 – СН2 – N
/ \
СН2 СН2 + СаCl2 →
\ /
С = О С = О
\ /
O O
/ \
Nа Nа
СН2СООН СН2СООН
\ /
 → N – СН2 – СН2 – N
→ N – СН2 – СН2 – N
 / \
/ \
СН2 СН2 + 2 NаCl
/ \
С = О С = О
\ /
O — Са — O
Применение:
Так как СаCl2 повышает свертываемость крови – применяется как кровоостанавливающее средство. СаCl2 – как антигистаминное средство, как противоядие при отравлении солями Мg2+. При рахите у детей, в зубоврачебной практике.
Хранение:
Хранят в хорошо укупоренной таре в проветриваемом помещении, так как СаCl2 хорошо впитывает влагу, но плохо растворяется в воде, по простому списку.
Цинк (Zn) в природе встречается в виде сульфида, карбоната. Содержится в подорожнике, змеином яде. Этот микроэлемент необходим для нормальной жизнедеятельности организма. В организме человека находится 2,5 г цинка.
Входит в состав эритроцитов, связан с ферментами, гормонами, витаминами. Оказывает влияние на рост и развитие всего организма, на обмен белков, жиров, углеводов. Цинк находится в гипофизе, поджелудочной железе, печени, оказывает антисклеротическое действие. Недостаток цинка приводит к уменьшению синтеза белка. Установлено, что снижение цинка в организме наблюдается при циррозе печени и онкологических заболеваниях.
ZnSO4 – Zinci sulfas – белый порошок без запаха, хорошо растворим в воде, медленнее в глицерине, нерастворим в спирте.
Получение:
Zn + Н2SO4 → ZnSO4 + Н2↑
ZnO + Н2SO4 → ZnSO4 + Н2О
Подлинность:
ZnSO4 + 2 NaОН → Zn(ОН)2↓ + Na2SO4
белый осадок
ZnSO4 + К4[Fe(CN)6] → K2Zn[Fe(CN)6] + K2SO4
светло-желтый осадок
ZnSO4 + ВаCl2 → ВаSO4↓ + ZnCl2
белый
нерастворимый осадок
Количественное определение:
1) Гравиметрический метод.
2) Комплексонометрия.
3) Йодометрический – основан на восстановлении красной кровяной соли К3 [Fe(CN)6] до желтой кровяной соли К4 [Fe(CN)6].
Применение:
Применяют наружно как антисептическое, вяжущее средство, иногда как рвотное средство.
Хранение:
Хранят по списку Б в хорошо укупоренной таре. Нужно помнить, что при хранении раствор ZnSO4 мутнеет вследствие образования в растворе Zn(ОН)2.
ВаSO4 – Barii sulfas adsorbatum – представляет собой белый порошок, слегка желтоватый, практически нерастворимый ни в чем.
Получение:
ВаСО3 + 2 НCl → ВаCl2 + Н2О + СО2↑
ВаCl2 + Н2SO4 → ВаSO4↓ + 2 НCl
Подлинность:
После превращения ВаSO4 в его растворимую соль определяют его подлинность:
ВаSO4 + Na2СО3 → ВаСО3 + Na2SO4
ВаСО3 + Na2SO4 → ВаSO4↓ + Na2CO3
Количественное определение:
Гравиметрический метод.
ГФ требует определение дисперсности, для этого берут: 5 г ВаSO4 и 50 мл воды очищенной, помещают в мерный цилиндр и определяют скорость оседания взвеси. Степень дисперсности можно определить с помощью азокрасителя – хризохенин.
Применение:
Применяют внутрь в больших количествах для диагностики жизненно важных органов, систем. Так как препарат применяется внутрь в больших количествах, то ГФ предъявляет строгие требования к данному препарату: никаких примесей!
Хранение:
ВаSO4 поступает с завода в двойной упаковке, внутри упаковка из пергаментной бумаги. Пакеты с ВаSO4 должны храниться отдельно от всех карбонатов, так как возможно образование карбоната Ва, по списку «Б».
Ртуть (Hg) – сравнительно мало распространена в природе. Иногда встречается в самородном виде, чаще в виде киновари HgS. Она и служит основным методом получения ртути.
HgS + О2 → Hg↓ + SО2↑
В очень небольших количествах ртуть встречается в растительных и живых организмах ее ρ = 13,6 г/мл, температура замерзания 390С, пары ядовиты.
Особенностью ртути является способность растворять металлы с образованием амальгамы – смесь ртути и металла. Исключение составляют – железо, никель, поэтому ртуть транспортируют или в никелевых или в железных сосудах.
HgО (окись ртути желтая) – Hydrargiri oxydum flavum.
Получение:

 HgCl2 + 2 NaОН → Hg(ОН)2 + 2 NaCl
HgCl2 + 2 NaОН → Hg(ОН)2 + 2 NaCl
HgО Н2О
Мелкодисперсионный порошок желтого или желто-оранжевого цвета. Растворим в НCl, НNО3. На свету HgО чернеет. Препарат должен быть свободен от щелочей, закисной ртути, от металлической ртути.
Подлинность:
Подтверждается путем растворения окиси ртути желтой в соляной кислоте:
HgО + 2 НCl → HgCl2↓ + Н2О
осадок
белого цвета
HgО + 2 КОН → Hg(ОН)2↓ + К2О
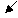
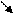 белый осадок во времени желтеющий
белый осадок во времени желтеющий
HgО Н2О
HgО + 2 КJ → HgJ2↓+ К2О
осадок
коралловый
HgCl2 + Na2S → 2 NaCl + HgS↓ осадок черного цвета
Количественный метод:
Метод нейтрализации:
HgО + 4 КJ + Н2О → К2[HgJ4] + 2 КОН
р-в Несслера
ф/ф
КОН + НCl → КCl + Н2О
Ртуть в небольших количествах концентрируется в почках и печени. Установлено, что ртуть оказывает патологическое влияние на фагоцитарную активность, снижает иммунологическую защиту. Так как ртуть способна образовывать комплексные соединения с ДНК, то угнетается активность некоторых ферментов.
Все соединения ртути токсичны. При попадании внутрь ртуть распределяется по всему организму, медленно выводится, то отравление сказывается на всех функциях организма. Однако окись ртути обладает бактерицидным и антисептическим действием.
Хранение:
Хранят по списку Б, в темных склянках, защищая от прямого попадания света, во избежании разложения.
Симптомы при отравлении ртутью: металлический вкус во рту, боль в животе, упадок сердечной деятельности, расстройство кишечника.
Первая помощь: антидотум металлурум (Na2S + MgS), активированный уголь, молоко, слизистые отвары. Нельзя применять раствор хлорида натрия, так как ртуть хорошо взаимодействует с хлором, происходит улучшение процесса всасывания ртути!
Hg2+ + 2 NaCl → HgCl2 + 2 Na+
Вопросы:
- Перечислите фармакопейные препараты, содержащие элементы II группы ПСЭ.
- Укажите характерные свойства данных фармакопейных препаратов.
- Какими реакциями устанавливается подлинность MgSO4, ZnSO4, BaSO4?
- Перечислите методы количественного определения данных веществ.
- Укажите реакции подлинности для хлорида кальция.
- Какой препарат данной группы представляет собой сильное токсичное вещество?
- Как определить наличие (подлинность) окиси ртути (II).
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!