
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №11
|
|
|
|
«Эфиры (этеры)»
Эфиры – продукты замещения Н+ на радикалы в углеводородах.
Общая формула R-O-R1
Простые эфиры – замещение атомов Н+ в гидроксиле спиртов или образовавшиеся из 2-х молекул спирта с отщеплением Н2О.
Первые два эфира: диметиловый и метилэтиловый.
СН3-О-СН3
газы
СН3-О-С2Н5
Остальные простые эфиры – жидкости.
Температура кипения эфиров меньше, чем температура кипения спиртов.
Получение:
Н2SO4
С2Н5ОН + НО-С2Н5 → C2H5-O-C2H5
-H2O диэтиловый эфир
Диэтиловый эфир – Aether medicinalis.
В медицине применяют диэтиловый эфир: эфир медицинский и эфир для наркоза.
Диэтиловый эфир впервые получен в 1540 г. ученым Кордусом, открытие было повторено Гей-Люссаком в 1807г. При синтезе данного вещества нужно помнить об образовании пероксидного соединения эфира; наличие говорит о несоблюдении технологии производства. Для очистки примесей диэтиловый эфир промывают водой, высушивают над хлористым кальцием и перегоняют с металлическим натрием.
Дополнительная очистка: с помощью гидросульфата магния, щелочного раствора, перманганата калия (KMnO4), затем снова промывают водой и перегоняют собирая фракцию при температуре 350С. Оба препарата отличаются друг от друга только по температуре кипения, по степени чистоты. Растворимы в любых соотношениях со спиртом, бензолом, хлороформом, маслами. При работе с диэтиловым эфиром соблюдают технику безопасности: огнеопасен. Перед выполнением анализа проводят проверку на наличие пероксидов.
Подлинность: проверка на чистоту предусматривает определение примесей, содержание которых должно быть в допустимых пределах (содержание кислот, определение нейтрализации водного извлечения). Примесь пахучего органического вещества (СН3-СН2-ОН) определяется путем выпаривания на фильтрованной бумаге (не должно остаться постороннего запаха).
На летучесть примеси определяют по массе остатка, полученного при выпаривании и высушивании (температура 100-1050С) 50 мл. препарата, сухой остаток не должен превышать 0,001 гр. Наличие пероксидов в эфире устанавливают по реакции:
C2H5-O-O-C2H5 + 2KJ + H2O → I2 + C2H5-O-C2H5 + 2KOH
(желтоватое окрашивание – наличие примесей)
Примесь альдегидов определяют по раствору Несслера:
O
//
CH3-C + 3KOH + K2[HgJ4] → Hg↓ + CH3COOK + 4KJ + 2H2O
\
H
Не допускается образование осадка, допустима слабая алюмисцентность.
Эфир для наркоза:
Требуется высокая степень чистоты → более узкое значение температуры кипения и плотности. Для этого препарата устанавливают количество примесей воды с помощью пикриновой кислоты, которая окрашивает препарат в желтый цвет.
Оба препарата хранятся по списку Б в хорошо укупоренной таре оранжевого стекла, защищенном от света месте, вдали от огня, склянки укупорены корковой пробкой с пергаментной прокладкой и заливают цинковой желатиновой массой, не растворимой в эфире, с резиновой пробкой. Эфир для наркоза хранят в условиях отсутствия контакта с кислородом воздуха, и не допускается образование пероксид соединений. Хранят во флаконе оранжевого стекла по 150 мл, укупоренного корковой пробкой, под которую кладут металлическую фольгу, а поверхность заливают специальной мастикой.
Фольга (обычно цинковая) предохраняет от растворения, восстанавливает образовавшиеся пероксиды и альдегиды.
C2H5-O-O-C2H5 + Zn → ZnO + C2H5-O-C2H5
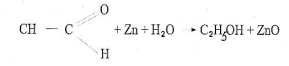
Эфир для наркоза подвергается контролю каждые 6 месяцев. Эфир медицинский используют как растворитель для приготовления настоек, экстрактов, некоторых лекарственных форм для наружного применения и для фармацевтического анализа.
Эфир для наркоза применяется ограниченно, т.к. для ингаляционного наркоза применяется менее токсические вещества (N2O, циклопропан, фторотан).
Эфир для наркоза подвергается испытанию на ацетон. В последнее время выпускается эфир для наркоза стабилизационный (Aether pro narcogi stabilisatum), срок годности – 3 года.
Простой эфир – Димедрол (Dimedrolum).
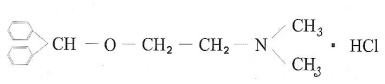
Димедрол можно рассматривать как производный этаноламина и ароматических спиртов (бензгидрол). Получают его по следующей схеме:
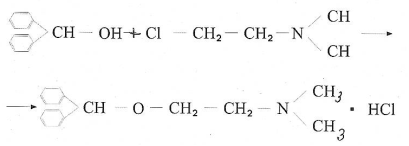
Димедрол хорошо растворим в воде, спирте, хлороформе, мало растворим в эфире. Димедрол представляет собой белый кристаллический порошок, гигроскопичен, с температурой плавления 167-1720С.
Подлинность:
1) Используют ультрафиолетовую спектроскопию 0,05% раствора димедрола в этаноле, наблюдается максимум поглощения при длине волны 244, 253, 261 нм.
2) Под действием концентрированной серной кислоты димедрол может образовывать оксониевую соль димедрола. Окраска – ярко-желтая постепенно переходящая в кирпично-красную.
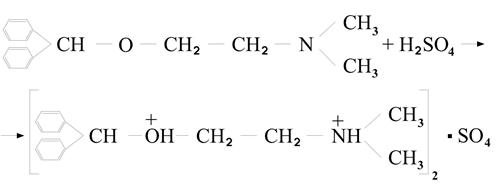
Если к раствору оксониевой соли добавить воды, то окраска изчезнет
3) С концентрированной азотной кислотой димедрол окрашенных продуктов не имеет, но при добавлении к раствору димедрола нитрующей смеси (H2SO4 и HNO3 1:9) – красное окрашивание. По истечении времени красное окрашивание переходит в коричневое, коричневое в желтое, желтое в оранжевое.
4) При взбалтывании с CHCl3 поверхностный слой приобретает фиолетовое окрашивание.
5) С реактивом Фреде димедрол дает желтое окрашивание, которое при нагревании переходит в красное.
6) С реактивом Марки – оранжевое окрашивание, при повышении температуры – красно-коричневое.
7) При добавлении к водному раствору димедрола смеси соляной кислоты, сульфата меди, тиоцианата аммония (NH4SCN) – коричневый осадок.
8) При кипячении димедрола в соляной кислоте -гидролиз димедрола с образованием исходных продуктов реакции.
9) Препарат дает качественные реакции на хлорид аммония.
Качественная реакция - образование оксониевой соли.
Количественное определение:
1. метод неводного титрования - титруют 0,1% М раствором хлорной кислоты в среде безводной уксусной кислоты и ацетата свинца (СН3СОО)2 РЬ или (CН3COO)2Hg:
2. метод нейтрализации - алкалиметрия (0.1М NaOH по связанной HCl); индикатор – фенолфталеин
3. йодохлорметрическое титрование - реакцию проводят в присутствии йодида калия, который взаимодействует с избытком хлора выделяя молекулы йода, которые
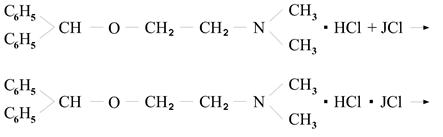 оттитровывают тиосульфатом натрия.
оттитровывают тиосульфатом натрия.
→ JCl + KJ → J2 + KCl;
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
4. можно использовать метод аргентометрии по связанной соляной кислоте.
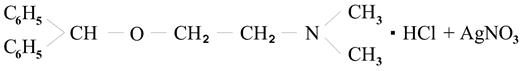 →
→
Хранение: хранят димедрол по списку Б в хорошо укупоренной таре, предохраняют от света и влаги, т.к. препарат гигроскопичен; нужно помнить, что при хранении препарат слеживается.
Применяют димедрол в качестве противогистаминного, антиаритмического средства в виде растворов и таблеток. Обладает наркотическим и снотворным действием.
Вопросы:
- Что такое эфиры?
- Диэтиловый эфир – его реакции доброкачественности.
- Димедрол – реакции установления подлинности.
- Методы количественного определения димедрола.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5496; Нарушение авторских прав?; Мы поможем в написании вашей работы!