
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 13
H-C-R
O
Лекция № 12
«Альдегиды, их производные»
Альдегиды - органические соединения, в которых карбонильная группа (С=О) связана с водородом и радикалом R.
||
Альдегиды имеют повышенную температуру кипения. Хорошо присоединяют аммиак и другие азотосодержащие нуклеофилы. Продукты присоединения малоустойчивы и легко подвергаются дегидратации и полимеризации. В результате полимеризации циклических соединений при нагревании с разбавленной кислотой легко разлагаются, освобождая альдегид.
Могут быть использованы реакции с азотосодержащими нуклеофилами.

Количественное определение:
1) йодометрический метод - в щелочной среде с образованием гипойодита.
J2 + 2 NaOH → NaJ + NaOJ+ H2O
Гипойодит окисляет формалин до муравьиной кислоты.
HCOH + NaOJ + NaOH → HCOONa + NaJ + H2O
NaOJ + NaJ + H2SO4 → J2 + NaSO4 + H2O
J2 + 2Na2S2O3 → Na2S4O6 + 2NaJ
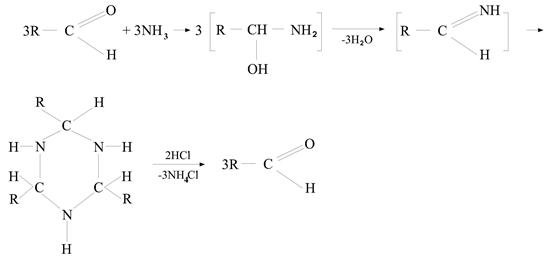
Метенамин (гексаметилентетрамин, уротропин)
Получение: конденсацией метаналя и аммиака из водных растворов.


Подлинность:
1) Альдегиды хорошо окисляются. Для них характерна рекция серебряного зеркала, которая протекает с аммиачным раствором нитрата серебра.
AgNO3 + 3NH4 → [Ag(NH3)]OH + NH4NO3
Реактив Толленса
O
//
H-C + 2[Ag(NH3)]OH → 2Ag↓ + HCOOH + 4NH3↑ + H2O
\ при этом наблюдается металлический памт
H
2) Альдегиды могут восстанавливать медь (II) до меди (I). Для этого проводят реакцию с реактивом Фелинга и нагревании. Сначала образуется желтый осадок, затем красный осадок Cu2O.
О О
// //
2KNa[Cu(C4H4O6)4] + H-C + 3NaOH + 2KOH → 2CuOH↓ + HC + 4KNaC4H4O6 + Н2О
\ \
H ONa
t
2CuOH → Cu2O + H2O
3) Альдегиды взаимодействуют реактивом Несслера в щелочной среде, выпадает осадок темного цвета.
O
//
K2[HgJ4] + H-C + 3KOH → HCOOK + 4HKJ + Hg↓ + 2H2O
\
H
Формалин – водный раствор формальдегида (40%), стабилизированный метанолом.
Подлинность:
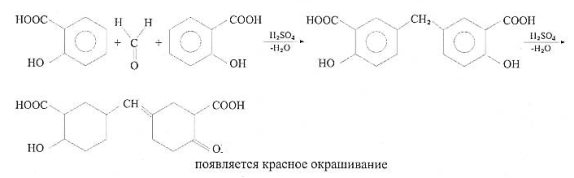
Для формалина присущи все реакции, характерные для альдегидов. Помимо ГФ рекомендует для установления подлинности реакцию конденсации с салициловой кислотой.
Подлинность: при нагревании смеси препарата с разбавленной серной кислотой образуется аммонийная соль, из которой в щелочной среде выделяется аммиак.
(CH2)6N4 + 2H2SO4 + 6H2O → 6HCOH + 2(NH4)2SO4
(NH4)2SO4 + 2NaO → 2NH3↑ + Na2SO4 + 2H2O
При добавлении соляной кислоты - красное окрашивание.
Испытание на чистоту: не допускается присутствие примесей органических соединений, параформа, солей аммония.
Количественное определение:
1) метод нейтрализации (по ГФ) - нагревание с 0,1 М раствора серной кислоты. Избыток оттитровывают раствором щелочи концентрации 0,1 моль/л (индикатор - метиловый красный);
2) йодометрический метод.
Вопросы:
- Какие органические вещества называются альдегидами?
- Формальдегид – его реакции подлинности.
- Производное альдегидов – гексаметилен-тетрамин (уротропин).
- Применение уротропина, хранение.
«Углеводы. Глюкоза»
Углеводы широко распространены в природе, играют большую роль в жизни человека, т.к. входят в состав пищи, причем потребность человеческого организма в энергии удовлетворяется большей частью за счет углеводов. При всех процессах жизнедеятельности как у высших животных и растений, так и у низших организмов, происходят сложные цепи химических превращений углеводов, т.е. углеводный обмен. В последнее время выяснилось, что углеводы участвуют в процессе передачи наследственных свойств, т.е. нуклеотиды построены из производных углеводов. Многие углеводы препятствуют свертыванию крови, проникновению патогенных микроорганизмов, т.к. укрепляют оболочки клеток, у растений принимают участие в фотосинтезе.
Углеводы - важный класс природных соединений как растительного, так и животного происхождения. Название углеводы объединяет довольно разнообразные по своим свойствам вещества.
Классификация углеводов:
1) моносахара (моносахариды) - углеводы не подвергаются гидролизу;
2) дисахара (дисахариды) - углеводы гидролизуются до моносахаров;
3) полисахара (полисахариды) - углеводы подвергаются гидролизу.
Дисахара и полисахара - образуют группу «олигосахара».
Глюкоза - виноградный сахар - важный представитель моносахаров.
Фруктоза - фруктовый сахар - представитель моносахаров.
Общая формула: С6Н12О6
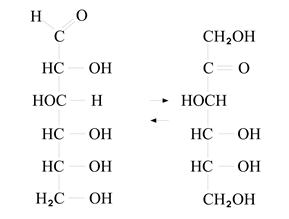
Глюкоза Фруктоза
Фруктоза является изомером глюкозы. Глюкоза содержит альдегидную группу и гидроксильные группы (как многоатомные спирты). Глюкоза имеет несколько ассиметрических атомов «С» и, следовательно, обладает оптической активностью (D- и L- изомеры).
Пространственным изомером глюкозы является галактоза.
Глюкозу можно изобразить в виде плоскости многоугольника.

α-глюкоза β-глюкоза
Получение глюкозы.
Глюкозa широко распространен и в природе, особенно в растениях (виноград, фрукты). Так в крови человека 0,08%-0,11% глюкозы.
Главным способом получения является гидролиз крахмала.
(С6Н10 06)n + mH20 → n1С6Н12О6
Глюкозу для медицинских целей получают путем очистки, перекристаллизации.
Обычная чистая глюкоза, получаемая перекристаллизацией из водных или спиртовых растворов представляет собой безводную глюкозу, находящуюся в α - форме. В равновесных растворах лишь ничтожное количество глюкозы находится в альдегидной форме, обладающей высокой реакционной способностью. Почти вся глюкоза находится в циклической форме, из которых преобладает β - форма (ее в 1,5 раза больше, чем α).
Глюкоза - белый кристаллический порошок, сладкого вкуса, хорошо растворим в воде, спирте.
Подлинность глюкозы:
1)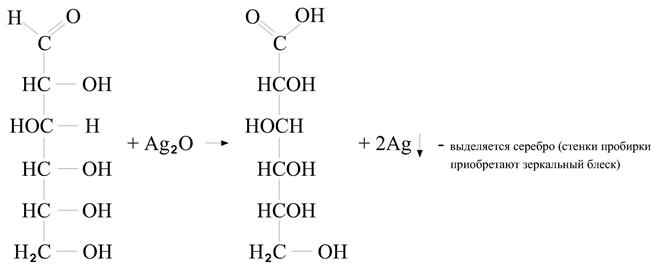
Глюкоза Глюконовая кислота
2)
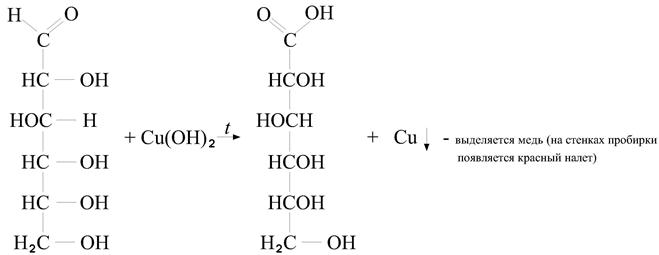
(Проба Троммера)
3) реакция раствора глюкозы с реактивом Фелинга, с реактивом Несслера также
подтверждает наличие глюкозы.
4)
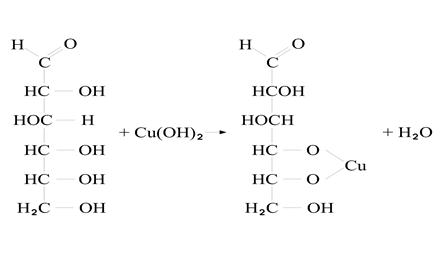
глюконат Cu
интенсивно-синяя окраска
Количественное определение:
В методе используется восстановительная способность глюкозы, т.к. она содержит альдегидную группу и спиртовые группы. Под действием мягких окислителей идет окисление альдегидной группы, под действием жестких окислителей окисляются спиртовые группы.
В основе йодометрического определения лежит реакция окисления глюкозы йодом в щелочной среде:
O O
// //
CH2OH(CHOH)4-C + J2 + 3KOH → CH2OH(CHOH)4—C + 2KJ + 2H2O
\ \
H OK
Т.к. реакция идет медленно, то прямое титрование невозможно, поэтому определение проводят методом обратного титрования:
3J2 + 6KOH → 5KJ + KJO3 + 3H2O
5KJ + KJO3 + 6HCl → J2 + 6KCl + 3H2O
Выделившийся йод оттитровывают раствором тиосульфата натрия:
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Применение: в виде 4,5-5% раствора глюкозы при шоке, сердечной недостаточности, при заболеваниях печени, почек.
Хранение: простой список, в хорошо укупоренной таре.
Вопросы:
- Какие органические вещества образуют группу углеводов?
- Классификация углеводов.
- Глюкоза, как альдегидоспирт, реакция подлинности.
- Йодометрический метод количественного определения глюкозы.
- Применение углеводов.
|
Дата добавления: 2014-01-05; Просмотров: 3936; Нарушение авторских прав?; Мы поможем в написании вашей работы!