
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. Физико-химические модели распространения химических загрязнений в окружающей среде
|
|
|
|
Причиной неконтролируемого глобального и регионального накопления химических продуктов является их тенденция к распространению, т.е. свойство выходить за пределы районаих применения и тем самым появляться во всей окружающей среде. Это приводит к их непреднамеренному и, как правило, нежелательному накоплению. В дальнейшем происходит, с одной стороны, модификация этих веществ под влиянием физико-химических и биологических процессов, а с другой стороны, изменение различных составляющих биосферы под их действием.
Скорость первой стадии распространения, а именно выход за пределы района применения, зависит от вида применения, насколько оно является открытой или закрытой системой; кроме того, от физико-химических процессов, которые происходят на месте применения, от естественных процессов обмена между районом применения и прилегающей территорией, а также от химической структуры исследуемого вещества.
В этой связи в понятие «применение» входит также технология применения, например, осуществляется распыление пестицида с земли или с помощью авиации (соответственно техника с большим или малым хранилищем распыляемого вещества), наносится слой краски распылением или просто кистью. За счет таких отличий в технологии применения изменяется количество вещества, поступающее в окружающую среду с места применения. Выход вещества за пределы места применения происходит также в виде твердых отходов или газов, уходящих в вентиляцию.
После того как химические материалы вышли за пределы района их применения; происходит их дальнейшее распространение, которое можно представить как негомогенное распределение. При открытом применении этот процесс зависит в основном от объема производства и устойчивости химических продуктов, что определяет обнаружение этих веществ повсеместно в результате природных процессов переноса.
Важными стадиями, определяющими подвижность и распределение посторонних в окружающей среде веществ, являются перенос (транспорт) между различными природными средами (водой, почвой и воздухом), их потребление и накопление в организмах, а также перенос веществ в этих средах, в частности живыми организмами. Эти факторы переноса будут ниже рассмотрены отдельно.
Перенос между различными средами. На рис. 7.1 представлена схема процессов переноса веществ в биосфере. Распределение химических соединений между воздухом, водой и почвой происходит в соответствии с их физико-химическими свойствами, причем, разумеется, факторы окружающей среды играют здесь решающую роль. В настоящее время с помощью более или менее сложных математических моделей предпринимаются попытки заранее рассчитать концентрации этих веществ в соответствующих средах. В этих моделях учитываются такие физико-химические свойства химических веществ, как молекулярная масса, давление пара и растворимость в воде. Для прогноза концентрации в соответствующей среде вводится понятие фугитивности (летучести). Фугитивность определяют как тенденцию вещества выйти из той фазы, в которой оно находится в данный момент; измеряют фугитивность в единицах давления (Па). Предполагается существование равновесия между химическим веществом, находящимся в различных контактирующих средах, что представляется маловероятным при взгляде на реальное положение в окружающей среде. В настоящее время имеются математические уравнения процессов перехода веществ из одной среды в другую, которые позволяют на основании физико-химических свойств веществ при определенных внешних условиях дать количественную оценку концентраций веществ и полупериода процесса переноса.
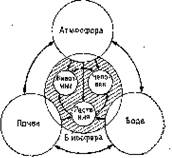
Рис. 7.1. Схема процессов переноса вещества в биосфере и вблизи ее.
Перенос почва–вода. Перенос химических продуктов, загрязняющих окружающую среду, на границе раздела почва–вода играет важную роль в процессе загрязнения вод в результате применения химических препаратов илиих поступления в почву с дождем, в результате искусственного орошения и собственно переноса этих веществ в почве, например, в виде водных растворов. Загрязнение вод может происходить как водой, стекающей по поверхности почвы (run-off, бегущая вода), так и водой, проникающей на всю глубину почвы (leaching, при загрязнении грунтовых вод). Для всех переходов химических продуктов через границу почва–водная фаза основную роль играют процессы адсорбции.
Адсорбцией называют связывание молекул или атомов жидкой или газообразной фаз на поверхности твердых тел. Коэффициент адсорбции почвы определяется как отношение концентрации адсорбированного вещества на твердом теле к его концентрации в водном растворе в равновесном состоянии. Адсорбцию химических соединений в почве можно описать двумя способами – с помощью уравнения Ленгмюра и уравнения Фрейндлиха.
Уравнение адсорбции Ленгмюра (изотерма адсорбции) первоначально было предложено для описания адсорбции газов на твердых материалах; зависимость адсорбции от концентрации адсорбируемого вещества записывается следующим образом:
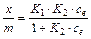 (1)
(1)
где х / т – отношение массы адсорбированного вещества к массе адсорбента, К 1 и K 2 – константы, характеризующие рассматриваемую систему, cе – равновесная концентрация вещества в растворе.
При выводе уравнения Ленгмюра предполагается, что теплота адсорбции не зависит от степени заполнения поверхности, иначе говоря, поверхность адсорбента предполагается однородной в энергетическом отношении. При выводе уравнения Фрейндлиха, напротив, предполагается, что вследствие гетерогенности адсорбирующей поверхности по мере увеличения заполнения адсорбента теплота адсорбции падает. Уравнение изотермы адсорбции Фрейндлиха записывается следующим образом:
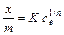 , lg
, lg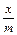 = lg k +
= lg k + 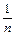 lg e (2)
lg e (2)
Здесь К – безразмерная константа адсорбции, или коэффициент адсорбции. Показатель степени 1/ n дает возможноть оценить интенсивность адсорбции. Адсорбция многих органических соединений в почве подчиняется в большей степени уравнению Фрейндлиха; зависимость по Ленгмюру наблюдается значительно реже. Если представить уравнение Фрейндлиха графически в логарифмических координатах по оси х, то зависимость х / т от концентрации становится прямолинейной с наклоном 1/ п, а константа К определяется точкой пересечения этой прямой с осью ординат.
Однако загрязняющие окружающую среду химические соединения адсобируются не только на органическом материале почвы, но и на минеральной фракции, причем эта часть суммарной адсорбции зависит от свойств почвы и структуры адсорбирующегосяхимического соединения. Адсорбция осуществляется не только связыванием поверхностью или взаимодействием между веществом и структурным скелетом почвы. В понятии адсорбции объединяются различные стадии процессов локализации химического вещества на отдельных участках поверхности и распределение адсорбирующегося вещества в объеме (водная фаза и органическое вещество почвы).
Десорбция адсорбированных веществ водой или солевыми растворами никогда не идет до конца. Это означает, что адсорбция обычно обратима неполностью. Расстояние между изотермами адсорбции и десорбции называют гистерезисом. Недесорбирующаяся часть состоит из прочно связанных молекул, которые можно снять с поверхности только интенсивной экстракцией органическими растворителями, и «неэкстрагируемого остатка». Последние могут быть, например, химическими веществами, которые получаются в результате реакций загрязняющих веществ с гуминовыми компонентами почвы с образованием ковалентных связей и их включением в полимерные макромолекулы гуминовых компонентов; также может происходить необратимое встраивание загрязняющих веществ в слоистую структуру глинистых минералов или в пустоты гуминовых макромолекул.
Как уже упоминалось, адсорбция играет основную роль в процессе перемещения химических соединений в почве, а также при их испарении из почвы и поглощении растениями. Адсорбция замедляет массоперенос в почве. Массоперенос растворенных химических веществ является функцией диффузии, конвекции и дисперсии веществ, а такжеих разложения абиотическими и биотическими реакциями.
Диффузия (диффузионный массоперенос) является физическим процессом, в ходе которого молекулы, атомы или ионы в результате теплового движения (броуновское движение) перемещаются из области большей концентрации в меньшую. Этот процесс происходит независимо от течения воды. Диффузионный массоперенос растворенных веществ в свободном объеме жидкости представляет собой произведение (со знаком минус) коэффициента диффузии и градиента концентрации в направлении, перпендикулярном некоторой воображаемой плоскости раздела. Коэффициент диффузии измеряется в м2/с и зависит как от молекулярных свойств растворенного вещества (например, относительной молекулярной массы и молярного объема), так и от свойств воды и других внешних условий. В пористом объеме почвы диффузия идет медленнее, чем в свободной жидкости. Сумма всех замедляющих диффузию факторов количественно оценивается импедансом. Последний является коэффициентом пропорциональности между коэффициентами диффузии, измеренными в почве и в свободной жидкости. Он изменяется в зависимости от вида растворенных молекул и типа почвы.
Конвекция (конвективный массоперенос) представляет собой принудительное перемещение растворенных веществ потоком воды. Она оценивается как произведение объемного потока воды (скорость фильтрации) и концентрации растворенных веществ в воде.
Дисперсией (дисперсионный перенос) называют перераспределение (соответственно перемешивание) растворенных веществ в движущейся в порах воде, вызванное неоднородностью поля скоростей потока в каждом отдельно взятом объеме воды в поре. Наряду с конвекцией дисперсия вносит свой вклад в общий массоперенос химических веществ в грунтовых водах, причем этот вклад зависит от скорости перемещения почвы. Дисперсия определяется как произведение (со знаком минус) объемного содержания воды в почве, градиента концентрации в перпендикулярном направлении к воображаемой плоскости раздела и дисперсионного коэффициента (м2/с). Последний зависит от средней скорости движения воды в порах; коэффициент пропорциональности называют дисперсионностью (м). Сумму дисперсионного коэффициента и коэффициента диффузии в поровом пространстве почвы называют гидродинамическим дисперсионным коэффициентом.
Можно учесть также дополнительные, однако более сложно вычисляемые параметры, учитывающие подвижность химических соединений, определенную из натурных испытаний, например:
– сток, сопровождающийся смещением в сторону;
– подъем воды из глубины почвы, вызванный испарением с поверхности;
– проявления трехфазных равновесий между самим веществом, его водным раствором и тем же веществом, адсорбированным на различных компонентах почвы;
– перенос (транспорт) вдоль трещин, ходов дождевых червей и других макропор.
Эти параметры, зависящие от сложной комплексной структуры почвы, значительно затрудняют прогноз перемещения химических веществ через почву, например, в грунтовые воды. Это особенно относится к переносу через макропоры, называемому преимущественным потоком (preferential flow). Для каждого загрязняющего почву вещества, вымываемого из почвы, он (этот перенос) составляет определенную долю, не зависящую от, казалось бы, оказывающих влияние факторов.
Так как химические соединения, прежде чем они оказываются в фильтрационных или грунтовых водах, находятся в непосредственном контакте со структурными составляющими почвы, весьма вероятно, что в ней появляются водорастворимые продукты превращений, образовавшиеся на основе ферментативных или абиотических реакций, причемих присутствие даже более вероятно, чем самого исходного вещества. Этот факт еще недостаточно учитывается при проведении анализа грунтовых вод. Поэтому перед анализом грунтовых вод на содержание какого-либо загрязняющего среду химического соединения необходимо выявить и провести анализ полярных продуктов превращений этого вещества, происходящих в почве.
Перенос вода–воздух. Переход вещества в природных условиях из водного раствора в атмосферу называют летучестью; этот процесс осуществляется в результате диффузии, обратный перенос называют сухим осаждением в воду; оба понятия относятся не к равновесным, а к динамическим процессам.
Скоростью улетучивания называют поток массы вещества, проходящий через границу вода–воздух; она определяется как количество вещества, проходящее через единицу площади в единицу времени. Эта скорость пропорциональна разности концентраций соответствующего вещества в обеих фазах.
F = K × c (4)
где F – поток вещества, выраженный в единицах массы за единицу времени на единицу площади; с – разность концентраций вещества в воде и газовой фазе. Коэффициент пропорциональности К называют общей скоростью переноса (в литературе встречается также определение – коэффициент общего переноса), он имеет размерность скорости, например м/с или см/ч. Если обозначить исходную концентрацию вещества в воде c 0, а начальную концентрацию в воздухе принять равной нулю – ситуация, которая наблюдается в случае однократного загрязнения вод, – то концентрация в водном растворе экспоненциально уменьшается во времени в соответствии с кинетическим уравнением реакции 1-го порядка
c = c 0×exp(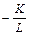 t) (5)
t) (5)
где L – глубина относительно поверхности воды; t – время.
Предпосылкой такого поведения является то обстоятельство, что концентрация в газовой фазе заведомо значительно ниже, чем в водной фазе, что практически всегда имеет место в открытых системах окружающей среды. Определяемое из уравнения (5) «время полупревращения» t 1/2 представляет собой количественную оценку летучести, так как оно не зависит от исходной концентрации. Величину, обратную скорости общего переноса К, называют сопротивлением общего переноса R; оно представляет собой сумму всех сопротивлений процесса переноса вещества через поверхность раздела фаз. Сопротивление жидкой фазы r 1 является обратной величиной по отношению к скорости переноса в жидкой фазе k 1:
r 1 = 1/ k 1 (6)
Сопротивление газовой фазы равно
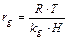 (7)
(7)
где R – универсальная газовая постоянная; Т – абсолютная температура; k g – скорость переноса в газовой фазе; Н – константа Генри.
Таким образом, скорость общего переноса К равна
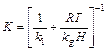 (8)
(8)
Константа Генри H играет важную роль при описании процесса улетучивания вещества из водного раствора. Обычно она определяется как отношение концентраций в газовой и водной фазах и является безразмерной величиной. Однако в литературе указывается, что константу Генри можно приближенно вычислить как отношение давления насыщенного пара вещества к его максимальной растворимости в воде, поскольку эти величины довольно легко измерить. Это относится также и к величине H в уравнениях (7) и (8). Заменив концентрацию в газовой фазе на давление, получим приближенную константу Генри в размерности (давление)×(объем)×(моль)–1. Разумеется, такое приближение верно только в случае ограниченной растворимости в воде и при соблюдении условий выполнения законов идеальных газов (случай большого разбавления).
Эту приближенную константу Генри в уравнениях (7) и (8) можно заменить на произведение безразмерной константы Генри и RT.
Если значение приближенной константы Генри более 500 Па×м3/моль, что свойственно, например, веществу с высоким давлением пара и/или низкой растворимостью в воде, то правое слагаемое в скобках уравнения (8) становится существенно меньше левого, и летучесть зависит только от значения k 1, т.е. определяется только жидкой фазой. Этому случаю соответствуют, например, легколетучие растворители. Так как k 1 мало зависит от свойств вещества, а определяется в основном внешними условиями, летучести веществ, контролируемые жидкой фазой, при одинаковых внешних условиях мало отличаются друг от друг, даже если давление их пара отличается на порядок. Однако если константа Генри ниже
0,5 Па×м3/моль, что характерно для веществ с низким давлением пара и/или высокой растворимостью в воде, левый член уравнения в скобках (8) становится малым по сравнению с правым, что равносильно тому, что летучесть контролируется газовой фазой и в значительной мере определяется константой Генри, т.е. давлением пара и растворимостью в воде.
Скорости переноса k 1 и k g зависят от внешних условий окружающей среды, особенно от скорости ветра и турбулизации воды, a k 1 – также и от температуры. Их зависимость от свойств вещества сводится главным образом, как и в случае диффузии, к зависимости от молекулярной массы и молярного объема. Так как эти величины для органических соединений редко отличаются более чем на несколько порядков, зависимость скорости переноса от свойств вещества резко ограниченна. Количественное выражение зависимости k 1 и k g от коэффициентов диффузии, скорости ветра, турбулизации и т.п. может быть дано на основе различных физических моделей, которые мы здесь не рассматриваем.
С помощью установленных выше физических закономерностей вместо экспериментальных измерений летучесть многих химических веществ из водного раствора можно достаточно точно рассчитать. Для получения приближенных данных необходимо знать только максимальную растворимость и давление насыщенного пара, так как ввиду малых вариаций для широкого спектра веществ скорости переноса можно получить экстраполяцией по известным значениям параметров модельных веществ (кислорода, диоксида углерода, воды). Однако экспериментальное определение летучести становится необходимым, если:
– растворимость в воде и/или давление насыщенного пара с трудом поддаются экспериментальному определению;
– вещество полностью растворимо, но при этом легко улетучивается из воды (например, ацетон);
– можно ожидать взаимодействий с другими содержащимися в воде веществами.
Сухое осаждение химических соединений из воздуха в воду происходит в соответствии с теми же закономерностями, что и для летучести, только в противоположном направлении.
Наряду с летучестью веществ из воды и их сухого осаждения из атмосферы в воду существуют еще и другие пути для материального обмена между водой и воздухом, – например, разбрызгивание ветром воды в море, влажное осаждение и удаление из атмосферы с дождем. Доля таких путей переноса в общем обмене химическими веществами между водными бассейнами и атмосферой зависит от географического положения и климатических условий, а также от физико-химических свойств этих веществ.
Перенос почва–воздух. В отличие от рассмотренных выше путей переноса транспортные процессы между почвой и воздухом оказываются самыми сложными, так как здесь большое значение имеют обменные процессы жидкость/твердая фаза, жидкость/газ и твердая фаза/газ.
Переход вещества из почвы в атмосферу путем диффузии в природных условиях называют летучестью из почвы, а обратный процесс – сухим осаждением в почву.
Прежде чем начать обсуждение процесса летучести химических веществ из почвы, следует вкратце рассмотреть летучесть самих этих веществ. Улетучивание идет аналогично улетучиванию химических соединений из водных растворов (уравнения (4) и (8)), причем сопротивление жидкой фазы 1/ k 1 принимается равным нулю, растворимость в воде (S, моль/м3) – равной 106/ М r, а разность концентраций (с, г/м3) – равной 106. Тогда летучесть чистого вещества равна
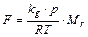 (9)
(9)
где k g – скорость переноса в газовой фазе, р – давление насыщенного пара; R – универсальная газовая постоянная; Т – абсолютная температура; M r – молекулярная масса. Накопление чистого вещества в окружающей среде происходит довольно редко, так что уравнение (9) в такой форме применяется мало.
Для химических веществ, адсорбирующихся на сухой поверхности почвы, уравнение (9) применимо, если вместо давления насыщенного пара чистого вещества подставить давление пара адсорбированного вещества. В области очень малых концентраций (млн–1) давление пара адсорбированных почвой веществ заметно снижено; с увеличением концентрации увеличивается и давление пара, причем при некоторой концентрации, величина которой зависит от природы вещества и почвы, это давление пара становится равным давлению насыщенного пара чистого вещества. Если потеря вещества с гладкой плоской поверхности с равномерным заполнением постоянна во времени, то для почвы такая закономерность не выполняется, так как почва шероховата и обладает сложной структурой, ее заполнение веществом неравномерно, и снижение концентрации в почве может привести к снижению давления пара. Летучесть химических соединений из почвы происходит поэтому так же, как и из водных растворов, в соответствии с кинетическим уравнением первого порядка.
Летучесть с влажной поверхности почвы существенно выше, чем с сухой. В настоящее время показано, что это явление нельзя свести к соиспарению, которое происходит при более высоких температурах и концентрациях благодаря взаимному влиянию воды и испаряющегося вещества. Вынос молекул воды и химического соединения из почвы происходит независимо друг от друга. Это легко обнаруживается благодаря тому, что скорость летучести химического продукта не изменяется, в то время как летучесть воды в атмосферу, насыщенную парами воды, подавляется; при этом поверхность почвы должна оставаться влажной. Увеличение летучести из влажной почвы по сравнению с сухой в большей степени объясняется частичной десорбцией химических соединений при их вытеснении водой. Этот факт указывает также на то, что летучесть химических соединений с влажной поверхности почвы происходит преимущественно из жидкой фазы.
Химические вещества, которые внесены в толщу почвы, переносятся из более глубоких слоев к обедненному слою, и этот процесс становится фактором, лимитирующим скорость улетучивания, если испаряющееся вещество имеет относительно более высокую константу Генри (например, линдан). Для веществ с малой константой Генри (например, прометон), напротив, происходит обогащение им поверхности почвы. При переносе растворенных посторонних окружающей среде веществ из нижних слоев почвы в верхние диффузия играет существенную роль только в том случае, если речь идет о газах и легколетучих веществах. Большей частью перенос вверх происходит за счет конвекции и капиллярных сил. Этот эффект называют «фитильным».
Летучесть химических веществ из почвы в атмосферу, разумеется, зависит и от других условий окружающей среды, например свойств почвы, температуры и скорости ветра. Сухое осаждение химических веществ из атмосферы на почву происходит по тем же законам, что и улетучивание из почвы.
Другим путем уноса вещества из почвы в атмосферу является перенос с пылью (ветровая эрозия), а в обратном направлении – влажным осаждением, например при их вымывании из воздуха дождем. Так же, как в случае перехода вода/воздух, доля каждого направления переноса зависит от физико-химических свойств вещества, а также типа почвы и климатических условий.
Модели процессов в атмосфере. Молекулярный и атомарный кислород. В атмосфере в результате различных процессов происходит образование электронно-возбужденных молекул кислорода. Низший уровень возбужденного состояния с энергией, превосходящей энергию основного состояния О2 всего лишь на 94,1 Дж, характерен для синглетного метастабильного кислорода O2(S). Вследствие того, что излучательный переход в основное состояние происходит медленно, радиационное время жизни метастабильного кислорода велико (примерно 65 мин). Наибольшие его концентрации наблюдаются на высотах 30-80 км с максимумом около 4×1010 см-3 на высоте 50 км. В стратосфере метастабильный кислород образуется при фотолизе озона:
O3 + hν ® O2(S) + O
Этот же процесс ответственен за образование O2(S) в верхних и средних слоях тропосферы, в которые проникает солнечная радиация с длиной волны менее 310 нм. Другие пути образования метастабильного кислорода в тропосфере связаны с переносом энергии от некоторых органических молекул в триплетном состоянии (Т).
В нижней тропосфере происходит также перенос энергии от фотовозбужденных молекул NO2:
NO2* + O2 ® NO2 + O2(S)
Эффективность этого переноса при тушении NO2* достаточно велика: она может достигать 7,5% от числа столкновений с возбужденными молекулами диоксида азота. Согласно расчетам, концентрация O2(S) за счет реакции связана с содержанием молекул NO2 в атмосфере примерным соотношением n[O2(S)]» 10-6n[NO2], а предельная концентрация метастабильного синглетного кислорода в тропосфере не превышает 107 см-3.
Частица O2(S) не отличается высокой реакционной способностью. С наибольшей скоростью она реагирует с разветвленными (тетраалкилзамещенными) алкенами, некоторыми гетероциклическими соединениями и с озоном. В атмосферных процессах гораздо более важное значение имеет вторая частица, образующаяся в реакции – метастабильный атомарный кислород. Он образуется также при фотодиссоциации некоторых других молекул:
N2O + hn ® N2 + O l < 230 нм
В верхней стратосфере метастабильный кислород образуется вместе с атомом кислорода в основном (триплетном) состоянии при фотолизе молекул О2
O2 + hn ® О(S) + О(T)
Метастабильный кислород – очень активная частица с временем жизни в стратосфере около 110 с. Химическое и физическое тушение его происходит с большой скоростью. Константа скорости реакции с молекулярным кислородом
O(S) + О2 ® О(T) + O2(S)
составляет 7·10-11 см3/(молекула·с). Тушение O(S) может происходить также и при столкновении с молекулами других газов (чаще всего – с азотом) и аэрозольными составляющими воздуха, поэтому в общем виде можно написать
O(S) + М ® О(T) + М* k = 2,9 10 – 11 см3/(молекула с)
Стоком метастабильного кислорода служит и взаимодействие с молекулами воды:
O(S) + Н2О ® 2НО* + 120,5 кДж k = 2,2 10 – 10 см3/(молекула с)
® О(T) + Н2О* k = 2,9 10 – 11 см3/(молекула с)
В наибольших концентрациях метастабильный кислород присутствует в стратосфере на высотах более 20 км. Атомарный кислород в основном состоянии образуется в тропосфере при фотолитическом разложении молекул диоксида азота
NO2 + hn ® NO + О(T)
и озона при облучении светом с длиной волны менее 1180 нм. Роль его в атмосферной химии весьма велика, поскольку он участвует в образовании и разложении озона как в стратосфере, та и в тропосфере:
О(T) + O2 + M ® O3 + M*; О(T) + O3 ® 2O2 + 392 кДж.
Гидроксильный и гидропероксидный радикалы. Гидроксильный радикал НО· образуется в результате прямого фотолиза воды, однако этот процесс происходит только в верхних слоях атмосферы, поскольку требует участия коротковолновой радиации. Гораздо более значимым источником радикалов НО· является взаимодействие метастабпльного кислород: O(1D) с молекулой воды.Замечено, что далеко не все образующиеся при фотолизе озона атомы O(1D) расходуются согласно реакции. Для сопоставления эффективности взаимодействия с образованием гидроксила в сравнении с тушением метастабильного кислорода можно использовать отношение
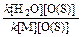 или
или 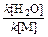
Подставив значения констант скоростей реакций, а также концентрации молекул воды (3,19·1017 см-3 при 25°С и относительной влажности 50%) и молекул атмосферных газов при давлении 1 атм (2,46·1019 см-3), получим отношение, равное 0,12. Еще некоторая часть атомов кислорода (около 8%) дезактивируется парами воды. Основными стоками гидроксильного радикала из атмосферы служат реакции с СО, СН4 и О3:
СО + НО* ® Н* + СО2; СН4 + НО* ® СН3 + Н2О; О3 + НО* ® НО2* + О2
Исходя из этих уравнений, можно приблизительно вычислить концентрацию радикалов НО· в атмосфере Земли

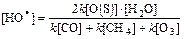
Подстановка средних значений концентраций реагентов и констант скоростей соответствующих реакций дает среднюю глобальную величину [НО·]=1,3·105 см-3. Полученное значение занижено относительно реального, поскольку в вычислении не учитывались дополнительные источники гидроксила. В стратосфере ими служат реакции метастабильного атомарного кислорода с СН4 и Н2:
СН4 + O(S) ® СН3 + НО*; Н2 + O(S) ® НО* + Н2
Константы скоростей реакций близки по величине и находятся в пределах (1-4)·10-10 см3/(молекула×с). В тропосфере дополнительным источником НО· служит взаимодействие озона с гидропероксидным радикалом
О3 + НО2* ® НО* + 2О2
Гидроксил образуется также при фотолитическом распаде некоторых кислот и пероксидов:
HNO2 ® NO + НО* HNO3 ® NO2 + НО*
H2O2 ® 2HO* ROOH ® RO* + HO*
Однако эти реакции, очевидно, не вносят вклада в нетто-продукцию НО· в глобальных масштабах, поскольку само образование этих кислот и пероксидов требует участия гидроксила (т.е. по большому счету эти реакции в условиях атмосферы обратимы). Более того, усиленное образование НNО3 может явиться причиной уменьшения содержания гидроксила как вследствие сухого и влажного осаждения этой кислоты на подстилающую поверхность, так и из-за реакции
HNO + HO* ® NO2 + Н2О
Напротив, окисление углеводородов и монооксида углерода хотя и начинается с «гибели» радикала НО·, тем не менее в условиях загрязненной антропогенными выбросами атмосферы приводит к его накоплению:
CH4 + 10 O2 ® CO2 + 5O3 + Н2О + 2НО*
Как видно, полное окисление одной молекулы метана (вся последовательность стадий этого процесса будет приведена ниже) имеет результатом образование двух радикалов НО· и пяти молекул O3, разложение которых также может привести к появлению дополнительного числа этих радикалов. Содержание радикалов НО· в атмосферном воздухе сильно варьирует по временам года и с географической широтой. Летом разница в его содержании составляет примерно порядок величины, а в другое время года больше.
Результаты измерений и моделирования позволяют считать, что в настоящее время средняя глобальная концентрация радикалов НО· составляет примерно 0,04 трлн-1, или 106 см-3. Вертикальное распределение НО· также неравномерно. При прочих равных условиях с высотой концентрация его в тропосфере убывает примерно пропорционально убыли содержания водяных паров. Однако выше тропопаузы наблюдается увеличение концентрации НО· до значений 107-108 см-3, что связано с резким возрастанием фотохимического образования метастабильного кислорода, не только расщепляющего молекулы воды, но и инициирующего окисление молекулярного водорода и метана.
Гидропероксидный радикал НОО· образуется при быстром взаимодействии молекулярного кислорода с атомарным водородом, появляющимся, например, при фотолитическом разложении некоторых органических соединений:
H* + O2 + M ® HO2* + M*
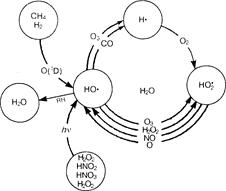
Рис. 7.2. Превращения водородсодержащих частиц в атмосфере
Дополнительным источником, особенно важным для стратосферы, выступает реакция гидроксила с озоном. В тропосфере он может образовываться также в реакции:
НО* + H2O2 ® НО2* + H2O
Установлено, что радикал НО· активно окисляет монооксид азота:
НО2* + NO ® NO2 + НО*
Немногочисленные измерения указывают на примерно равномерное распределение гкдропероксидного радикала на высотах 5-30 км с концентрациями порядка 107-108 см 3. На рис. 7.2 приведена схема, отражающая основные связи и направления взаимных превращений водородсодержащих промежуточных частиц в земной атмосфере.
Оксиды азота. Молекулы NО и NО2 – одни из немногих известных устойчивых соединений с нечетным числом электронов. Поскольку каждая из них имеет орбиталь, занятую лишь одним электроном, они являются свободными радикалами, стабилизированными сопряжениеми двойных связей.
Моно- и диоксид азота играют важную роль в химии тропосферы и стратосферы. В нижней атмосфере им принадлежит видное место в контроле за содержанием радикалов гидроксила и, что особенно важно, озона. Из-за того что в воздухе обычно происходит довольно быстрое взаимное превращение NО и NO2 в научной литературе для их обозначения часто применяют символ NОх (NOх=NO+NO2).
Поступление NОх в атмосферу в настоящее время в равной мере связано с природными (выделение NО почвами, образование NО и NО2 при грозовых разрядах и в химических реакциях возбужденных частиц в стратосфере) и антропогенными источниками. Антропогенная эмиссия NОх. обусловлена главным образом окислением N2, при сжигании ископаемого топлива и биомассы. Общий поток NО сейчас оценивается величиной (44 ± 10) Мт N/год, из них (24±5) Мт N/год поступает из антропогенных источников.
Проведенные в различных регионах исследования показали, что концентрации NО в приземном воздухе изменяются от уровня, лежащего ниже предела обнаружения используемых методов анализа, до примерно 50 млрд - 1 (около 1,2·1012 см-3) в воздухе городов. Недавние измерения выявили сильную анизотропию широтного распределения монооксида азота в верхней тропосфере.
В случае NО важным стоком становится взаимодействие с радикалом гидроксила:
NO2 + НО* + M ® HNO3 + M*
Образовавшаяся азотная кислота удаляется из атмосферы путем сухого осаждения, внутри- и подоблачного вымывания. Концентрации НNО3 и HNO2 в городском воздухе обычно не превосходят 5-10 млрд–1.
Атмосферный озон окисляет NО2 с образованием радикальной частицы – триоксида азота
NO2 + O3 ® NO3* + O2
В дневное время NО3 быстро разрушается путем фотолитического распада
NO3* + hn ® NO + O2; NO3* + hn ® NO2 + O (Т)
Поэтому триоксид азота играет заметную роль только в «ночной» химии тропосферы. Ночью концентрации NO3, над континентами лежат в пределах от примерно 5·107 до 1010 см-3.
Для целей моделирования средние тропосферные концентрации в течение 12 ч «ночного» времени обычно принимают равными 2,4·108 см-3. Взаимные превращения азотсодержащих частиц в атмосфере приведены на схеме (рис. 7.3).
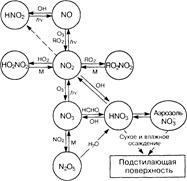
Рис. 7.3. Химическое поведение соединений азота в атмосфере
Средние концентрации некоторых радикалов и молекул на разных высотах в тропосфере и стратосфере над средними широтами Северного полушария по результатам измерений, составляют:
| 5 км | 20 км | 35 км | |
| Общее число молекул | 1,6·1019 | 1,9·1018 | 1,6·1017 |
| O2 | 3,3·1018 | 4,0·1017 | 3,3·1016 |
| H2О | 3·1016 | 8·1012 | 1·1012 |
| O3 | 7·1011 | 4,5·1012 | 1,3·1012 |
| O(Т) | 3,9·103 | 1,6·106 | 8,3·106 |
| O(S) | 4,5·10-3 | 0,8 | |
| CH4 | 2,3·1013 | 2·1012 | 5·1010 |
| CO | 2·1012 | 3·1010 | 3·109 |
| NO2 | 3·108 | 2·109 | 1·109 |
| NO | 2·108 | 5·108 | 5·108 |
| HNO3 | 2·1010 | 1010 | 5·108 |
| HO | 8,5·105 | 106 | 3·107 |
| HO2 | 108 | 107 | 1·108 |
| H2O2 | 2·1010 | 2·108 | 2·109 |
Механизм образования озона в тропосфере. В нижней атмосфере образование озона происходит в две стадии, из которых первая лимитирует скорость всего процесса:
NO2 + hn ® NO + O(Т) (J = 7,2×10-3 с-1), O(Т) + O2 + M ® O3 + M*
Одним из главных химических стоков озона в тропосфере служит его реакция с NО
O3 + NO ® NO2 + O2, [ k = 1,8×10-14 см3/(молекула×с)].
Скорости реакций лимитирующих стадий записываются уравнениями
V = J[NO2] и V = k [O3][NO].
В стационарных условиях концентрация озона будет определяться соотношением
[O3] = 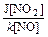
Типичное для воздуха городов отношение концентраций NO2 и NО, равное примерно 0,3, получим концентрацию озона 1,2·1011 см-3, или около 5 млрд-1. Она гораздо ниже, чем наблюдаемая даже в воздухе фоновых районов. Однако анализ уравнения показывает: концентрация О3 будет возрастать при увеличении скорости конверсии NО в NO2.
Механизм такой конверсии был установлен при изучении особого типа загрязнения городской атмосферы, впервые отмеченного в 1944 г. в Лос-Анджелесе и получившего название «фотохимического смога». В отличие от давно известного «лондонского смога» – густого тумана с примесью диоксида серы и частиц сажи, фотохимический смог возникает под действием солнечного света, чаще всего при инверсиях температуры и при низкой влажности воздуха. Признаком образования смога служит появление голубоватой дымки, состоящей из аэрозолей аккумуляционной моды и вызывающей ухудшение видимости. Наблюдается сильное раздражение слизистых оболочек глаз и дыхательных путей, что объясняется высоким содержанием (до 400-450 млрд-1) озона и некоторых других фотооксидантов.
Переход NО→NO2 ускоряется за счет образования при окислении СО и углеводородов пероксидных радикалов
HO2* + NO ® NO2 + HO*; RO*2 + NO ® RO* + NO2
Поэтому для понимания закономерностей образования и разрушения озона в нижней атмосфере необходимо знание источников и путей химических превращений восстановленных соединений углерода.
Окисление моноксида углерода. Единственным абиотическим стоком СО из атмосферы служит взаимодействие его с радикалом гидроксила. В результате образуется CO2, однако выход других продуктов зависит от условий протекания реакции. В «чистой» атмосфере, т.е. содержащей лишь небольшие (на уровне 10-20 трлн-1) количества NО, схема и конечный итог окисления СО могут быть представлены реакциями:
CO + HO* ® CO2 + H*
H* + O2 + M ® HO*2 + M*
HO*2 + O3 ® HO* + 2O2
CO + O3 ® CO2 + O2
Завершающей стадией может быть также взаимодействие двух гидропероксидных радикалов:
HO*2 + HO*2 ® H2O2 + O2
В этом случае общий итог процесса заключается в стоке не О3, а радикалов:
CO + HO* + HO*2 ® CO2 + H2O2
В воздухе, содержащем достаточно большие количества монооксида азота, окисление СО описывается реакциями:
CO + HO* ® CO2 + H*
H* + O2 + M ® HO*2 + M*
HO*2 + NO ® NO2 + HO*
NO2 + hn ® NO + O
O(Т) + O2 + M ® O3 + M*
CO + 2O2 ® CO2+ O3
Как видно, окисление СО в загрязненной антропогенными выбросами атмосфере приводит к окислению NО до NO2 и далее – к образованию озона.
Окисление метана и его гомологов. Химическим стоком метана в тропосфере также служит его реакция с гидроксилом. Общий итого зависит от содержания в воздухе легко окисляющегося монооксида азота. В «чистом» воздухе последовательность реакций такова:
CH4 + HO* ® CH3 + H2O
CH3 + O2 + M ® CH3O2* + M*
CH3O2* + HO*2 ® CH3OOH + O2
CH3OOH + hn ® CH3O* + HO*
CH3O* + O2 ® CH2=O + HO*2
CH4 + O2 ® CH2=O + H2O
Образовавшийся формальдегид относительно устойчив, однако взаимодействие его с радикалом НО· (или фотолитический распад на радикалы) дает начало новой последовательности реакций:
CH2=O + HO* ® CH=O + H2O
CHO + O2 ® CO + HO*2
HO*2 + O3 ® HO* + 2O2
CH2=O +O3 ® CO + H2O + O2
Учитывая превращения монооксида углерода в приведенных реакциях, можно записать:
CH4 + O2 ® CH2=O + H2O
CH2=O +O3 ® CO + H2O + O2
CO + O3 ® CO2 + O2
CH4 + 2O3 ® CO2 + O 2
Или же, приняв во внимание предыдущие реакции, получим:
CH4 + O2 ® CH2=O + H2O
CH2=O + HO* + HO*2 ® CO + H2O2 + H2O
CO + HO* + HO*2 ® CO2 + H2O2
CH4 + 2 HO* + 2 HO*2 + O2 ® CO2 + 2 H2O2 + 2 H2O
В присутствии NО общий результат окисления метана сильно изменится. Суммарно это можно представить следующим образом:
CH4 + 8O2 ® CO + 4O3 + H2O + 2HO*
Если принять, что дальнейшее окисление СО, то для полного окисления молекулы СH4 имеем:
CH4 + 10O2 ® CO2 +5O3 + H2O + 2HO*
Таким образом, в загрязненном воздухе накапливаются озон и радикалы гидроксила, и окислительный потенциал воздуха увеличивается. Например, формальдегид может выпадать с осадками на подстилающую поверхность. Турбулентный перенос и сорбция почвой – причины стока некоторой части молекул СО. Кроме того, при взаимодействии метоксильного и метилпероксидного радикалов с молекулами NО, могут образовываться так называемые «резервуарные газы»:
CH3O2* + NOx ® CH3O2NOx; CH3O* + NOx ® CH3ONOx
Дополнить эту схему можно реакциями, завершающимися образованием муравьиной кислоты:
CH2=O + HO*2 ® CH2(OH)OO*; CH2(OH)OO* + NO ® CH2(OH)O* + NO2
CH2(OH)O* + O2 ® HCOOH + HO2*
Гомологи метана. Скорость взаимодействия с гидроксильным радикалом сильно зависит от строения молекулы алкана. Вторичные и третичные атомы водорода метиловых (–СH2–) и метиновых (–СН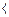 ) групп отщепляются легче, чем первичные.
) групп отщепляются легче, чем первичные.
Дальнейшие превращения образовавшихся на первой стадии алкильных радикалов происходят с участием молекул О2 и NО, как и в случае окисления метана. Алкилпероксидные радикалы могут образовывать относительно устойчивые продукты – алкилнитраты: RONO2. Образование алкилнитратов становится конкурентоспособным по отношению к окислению оксида азота только в случае гомологов метана с числом атомов углерода в молекуле более трех: если при окислении этана выход C2H5ONO2 составляет около 1% в расчете на вступивший в реакцию углеводород, то в случае н -октана он достигает 33%.
Другим направлением стока алкилпероксидного радикала может оказаться его взаимодействие с НО2·:
RO*2 + HO2* ® ROOH + O2
Образовавшийся алкилпероксид либо удаляется из атмосферы на подстилающую поверхность, либо вновь разлагается по одному из двух направлений:
ROOH + hn ® RO* + HO*; ROOH + HO* ® RO*2 + H2O
Ацилпероксидный радикал окисляет монооксид азота, образует надкислоту при столкновении с НО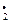 ; или присоединяет NO2:
; или присоединяет NO2:
RC(O)O*2 + NO ® RC (O)O* + NO2
RC (O)O*2 + HO2* ® RC (O)OOH + O2
RC (O)O*2 + NO2 ® RC (O)OONO2
Последняя реакция приводит к пероксиацилнитратам. Наиболее известным представителем этого класса вторичных загрязнителей атмосферы является пероксиацетилнитрат (ПАН) CH3C(О)OONO2. Это соединение, образующееся при окислении ацетальдегида, впервые было обнаружено в составе компонентов фотохимического смога в Лос-Анджелесе. Оно относится к сильнейшим фитотоксикантам. Совместное действие ПАН, пероксида водорода и алкилпероксидов ROOH служит причиной интенсивного поражения растительности и наносит большой ущерб как естественным экосистемам, так и агрофитоценозам.
В ночное время, когда образующийся при окислении углеводородов диоксид азота не подвергается фотолитическому разложению, определенный вклад в тропосферный сток алканов вносит их взаимодействие с радикалом NО3·:
RH + NO3* ® R + HONO2
Однако скорость этого процесса мала: константы скоростей реакций триоксида азота с алканами С1-С9 лежат в пределах 10-18-10-16 см3/ (молекула·с).
Алкены и ароматические углеводороды. Углеводороды, содержащие в составе молекулы двойную связь, отличаются от алканов повышенной реакционной способностью. Их окисление в условиях тропосферы начинается с присоединения радикальных частиц или молекулы озона. Из приведенных ниже констант скоростей реакций [см3/(молекула×с)] четырех первых представителей гомологического ряда алкенов видно, что скорость присоединения гидроксила возрастает по мере замещения двойной связи алкильными группами: при переходе от этилена к дизамещенному 2-бутену она увеличивается почти в десять раз.
| Газ | HO· | O3 |
| Этилен | 8,1·10-12 | 1,7·10-18 |
| Пропилен | 2,5·10-11 | 1,1·10-17 |
| 1-Бутен | 3,3·10-11 | 1,1·10-17 |
| транс-2-Бутелен | 7,0·10-11 | 2,0·10-16 |
Присоединение радикала НО· инициирует цепь превращений, последовательность которых можно проследить на примере пропилена:
CH3CH=CH2 + HO* ® CH3CH¾ CH2OH
® CH3CH(OH)CH2
CH3CHCH2OH + O2 ® CH3CH(OO)CH2OH
CH3CH(OO)CH2OH + NO ® CH3CH(O)CH2OH + NO2
CH3CH(O)CH2OH + O2 ® CH3COCH2OH + H2O*
CH3CH(O)CH2OH ® CH3CH=O + CH2OH
CH2OH + O2 ® CH2=O + HO2*
Из этих уравнений видно, что инициируемое радикалом НО· окисление алкенов в условиях антропогенного загрязнения воздуха сильно влияет на конверсию NО®NO2 и тем самым -на образование озона. Действительно, даже неполное окисление молекулы пропилена приводит к образованию четырех молекул NO2:
C3H6 + 4O2 + 4NO ® CH3CH=O + 4NO2 + CO2 + H2O
Другими продуктами окисления в загрязненном воздухе являются низшие карбоновые кислоты (муравьиная и уксусная, и пероксиацетилнитрат:
CH3CHO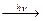 CH3C=O
CH3C=O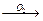 CH3C(O)OO*
CH3C(O)OO*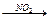 CH3(O)OONO2
CH3(O)OONO2
Заметную фракцию органических компонентов атмосферы образуют ароматические углеводороды. Особенно большие количества этих соединений обнаруживаются в воздухе городов: на долю бензола, толуола и его ближайших гомологов здесь обычно приходится 30-40% общего содержания Сорг. Окисление ароматических углеводородов инициируется радикалами гидроксила. Их реакционная способность сильно зависит от степени замещенности ароматического ядра и возрастает с увеличением числа алкильных заместителей. Отмечено несколько направлений, по которым происходит окисление аренов. Главные из них – замещение в бензольном ядре и процессы раскрытия цикла с последующей фрагментацией. В результате первых из бензола и толуола образуются фенолы и нитрофенолы:
Гомологи бензола при фотостимулированном окислении дают большое число различных продуктов. При окислении толуола в «смоговых камерах» зарегистрировано образование 47 соединений, более половины из которых – диальдегиды и альдокетоны. Эти дикарбонильные соединения легко разлагаются под действием света в ближней ультрафиолетовой области спектра с образованием радикалов. Например, скорость фотолитического разложения метилглиоксаля, одного из главных продуктов окисления толуола, при прочих равных условиях в 15 раз превышает скорость фотолиза формальдегида.
Приведенный материал показывает, что при окислении углеводородов происходит образование чрезвычайно реакционно-способных свободных радикалов. В свою очередь, радикальные частицы (HO2·, ROO·) легко окисляют NО в NО2 и тем самым ускоряют синтез и накопление в загрязненной атмосфере озона. Наиболее интенсивно эти процессы происходят в крупных городах, особенно в условиях высокого уровня солнечной радиации и слабой циркуляции воздуха (например, при инверсиях температуры). В особо тяжелых смоговых ситуациях концентрация озона в воздухе городов может достигать 450 мкг/м3. Однако озоновое загрязнение не является исключительно проблемой городов. В настоящее время оно приобретает характер крупно региональный и даже глобальный.
Озон в сельских и фоновых районах. Высокие концентрации озона в последние десятилетия регистрируются не только в городах, но также в воздухе фоновых районов и даже над морями и центральными частями океанов.
Причиной этому служит не только перенос озона с воздушными массами из городов, но и образование его непосредственно в сельской местности в результате реакций, механизмы которых были рассмотрены выше. Встает вопрос об источниках реагентов, необходимых для синтеза озона. Эти компоненты легко окисляются с образованием широкого спектра продуктов. Наиболее значимым химическим источником NО2 служит реакция: HO2* + NO ® HO* + NO2.
В нижней атмосфере главный химический сток озона – это его реакция с NО: NO + O3 ® NO2 + O2.
Однако накопление озона будет происходить только в случае, если имеет место быстрая конверсия NО NО2. В сельских районах это обеспечивается за счет реакции NО с радикалами, образующимися при окислении фитогенных (выделяемых растениями) непредельных углеводородов.
NО2. В сельских районах это обеспечивается за счет реакции NО с радикалами, образующимися при окислении фитогенных (выделяемых растениями) непредельных углеводородов.
Совместное окисление NО и фитогенных углеводородов - не единственная причина повышенного содержания озона в воздухе сельских районов.
Атмосферная химия кислород-, азот- и серосодержащих органических соединений. Производные углеводородов составляют заметную фракцию органических компонентов атмосферы. Как было показано в предыдущем разделе, многие из них (карбонильные соединения, кислоты и спирты) образуются непосредственно в тропосфере в результате окисления углеводородов. Кроме того, они поступают в атмосферу из наземных источников. В летучих выделениях растений обнаружено множество альдегидов, кетонов и спиртов. Соединения этих классов содержатся также в отработавших газах автомобилей, в газовых выбросах промышленных предприятий и объектов коммунального хозяйства. В выделении в атмосферу некоторых азот- и серосодержащих органических соединений также участвуют природные и антропогенные источники. Окисление производных углеводородов в загрязненной оксидами азота атмосфере приводит к вторичным загрязняющим компонентам – озону, различным пероксидным соединениям, нитрозаминам и т.д. Поэтому атмосферной химии производных углеводородов сейчас уделяется большое внимание.
Альдегиды и кетоны. Для карбонильных соединений характерны два направления химических превращений в газовой фазе атмосферы: фотолитическое разложение и окисление, инициируемое радикальными частицами, главным образом радикалами гидроксила.
Фотолитическое разложение карбонильных соединений протекает по уравнению: RRC=O + hn ® R* + RC*=O.
Дальнейшие превращения алкильных и ацильных радикалов происходят по схемам, рассмотренным в общем виде ранее. В случае альдегидов процесс носит довольно сложный характер. В частности, было установлено, что квантовые выходы Н2 и СО при фотолизе формальдегида в обедненной кислородом атмосфере могут достигать 7,07 и 11,6 соответственно. Это послужило основанием для предположения о цепном характере реакции, включающем образование короткоживущих аддуктов формальдегида с радикалами НО· и НО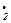 . Однако механизм фотолитического Разложения и последующих стадий окисления альдегидов до сих пор изучен недостаточно.
. Однако механизм фотолитического Разложения и последующих стадий окисления альдегидов до сих пор изучен недостаточно.
Карбоновые кислоты и спирты. Атмосферная химия карбоновых кислот также исследована еще недостаточно полно. В литературе имеется мало сведений о продуктах их окисления и фотолиза в атмосфере. Между тем эти данные представляют интерес, так как низшие карбоновые кислоты служат важным промежуточным звеном в стоках алкенов. Фотолитическое разложение муравьиной кислоты в ближней ультрафиолетовой области спектра приводит к радикалам:
HCOOH + hn ® H* + COOH
+ hn ® HO* + HCO
+ hn ® H* + HCOO*
Считается, что фрагментация молекулы с образованием устойчивых продуктов: HCOOH + hn ® H* +HCOOH*, не играет значительной роли. Коэффициенты фотодиссоциации и квантовые выходы продуктов этих элементарных реакций неизвестны.
Основным химическим стоком карбоновых кислот в тропосфере служат, вероятно, реакции с радикалом НО·. Константы скоростей (k =10-13 (см3/молекула·с)) взаимодействия гидроксила с муравьиной, уксусной, пропионовой и масляной кислотами равны соответственно 3,2 ± 0,2; 6,0 ± 0,8; 16,0 ± 1,2 и 18,0 ± 1,6. Скорость процесса имеет одинаковый порядок со скоростью отщепления водорода от алканов. Это позволяет предполагать, что окисление гомологов муравьиной кислотой начинается с атаки гидроксилом водорода алкильной, а не карбоксильной группы:
RCH2COOH + HO* ® RCHCOOH + H2O
Константы скорости взаимодействия метанола и этанола с радикалом НО· составляют 1,1·10-12 и 3,3·10-12 (см3/молекула·с). Можно предположить, что радикал НО· отщепляет атом водорода как от алкильной, так и от гидроксильной группы спирта:
CH3OH + HO* ® *CH2OH + H2O
® CH3O* + H2O
В воздухе городов, в которых автомобильный транспорт использует спирты или смеси бензина и спиртов, концентрации относительно устойчивых алкилнитритов высоки. К сожалению, нельзя достоверно предсказать отдаленные последствия хронического поступления этих соединений в организм человека.
Амины. Исследованию поведения алифатических аминов в газофазных фотохимических реакциях уделялось значительное внимание в связи с проблемой образования в городском воздухе канцерогенных N-нитрозаминов. Проводимые в смоговых камерах эксперименты показали, что алкиламины с большой скоростью атакуются радикалом НО·. Константы скорости реакции метиламина и этиламина составили 2,2·10-11 и 2,8·10-11 см3/(молекула·с) соответственно.
Следующие стадии аналогичны постулированным для превращения алкильных радикалов: происходит образование пероксидного радикала при взаимодействии с O2, а затем амино-алкоксидного радикала, сопровождаемое окислением NO до NO2.
Серосодержащие соединения. Окисление диметилсульфида, являющегося основным органическим соединением серы природного происхождения, можно представить следующей схемой:
НО· О2 NO
CH3SCH3 ® CH3SCH2* ® CH3SCH2OO* ® CH3SCH2O* ® CH2=O+CH3S*
Дальнейшие превращения радикала СН3S· приводят к нескольким устойчивым соединениям серы, неизменно обнаруживаемым в опытах в смоговых камерах. Это прежде всего метан-сульфоновая кислота и диоксид серы. Образование метансуль-фоновой кислоты может происходить в результате реакций:
CH3S* + HO* ® CH3SOH; CH3SOH + O2 ® CH3SO2OH
Диоксид серы может образовываться в процессе различных реакций:
CH3S* + O2 ® CH3SO2* ® C*H3 + SO2; SO + O3 ® SO2 + O2
CH3SO*2 + NO ® CH3SO* + NO2; SO + NO2 ® SO2 + NO
Реакция с гидроксилом служит основным стоком диметил-сульфида в дневное время. Ночью же, по-видимому, главным стоком становится реакция с радикалом NO3, хотя константа скорости ее примерно в 20 раз меньше, чем для реакции с гидроксилом.
Метансульфоновая кислота - постоянный компонент морских аэрозолей. Концентрация этой кислоты в нижних слоях атмосферы вблизи экватора в центральной части Тихого океана обычно находится в пределах 9-75 нг/м3. Она относится к сильным кислотам и способна вытеснять НСl из NaCl, входящего в состав морского аэрозоля.
Хорошо растворимая в воде, метансульфоновая кислота окисляется в капельножидкой фазе атмосферных аэрозолей с образованием серной кислоты, и обе эти кислоты удаляются из атмосферы с осадками. Отметим, что «влажное осаждение» – характерный сток не только кислот, но и любых других хорошо растворимых в воде примесей атмосферы: низших карбонильных соединений, спиртов, аминов и др.
Таким образом, основной особенностью реакций токсикантов в атмосфере являются – радикальные, обуславливающие многообразие реакций.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2973; Нарушение авторских прав?; Мы поможем в написании вашей работы!