
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 8. Миграция химических загрязняющих веществ в биосфере
|
|
|
|
Миграция химических загрязняющих веществ (ХЗВ) в биогеоценозе как наиболее геохимически активном блоке геосистемы тесно связана с их поведением в сопряженных с почвой природных водах.
Резкие изменения скорости миграции и темпов накопления химических элементов вызываются наличием так называемых геохимических барьеров. Выделяют следующие геохимические барьеры: 1) биогеохимические, вызванные интенсивным закреплением значительного числа макро- и микроэлементов живыми организмами; 2) физико-химические, увеличивающие или уменьшающие подвижность элементов за счет изменения степени окисления, адсорбции, образования гидроксидов, сульфидов и т.п. Различают барьеры окислительные, восстановительные, глеевые, восстановительные сульфидные, сульфатно-карбо-натные, щелочные, кислые, испарительные, адсорбционные, термодинамические; 3) механические, возникающие при изменении скорости воздушных или водных потоков, и вследствие фильтрационных эффектов. Роль механического барьера могут исполнять пористые известняковые породы, песчаные и глинистые прослои в толще породы и т.п.
Таблица 8.1. Подвижность химических элементов в зоне гипергенеза
| Подвижность | Элемент | Условия подвижности |
| Очень подвижные | S, C1, I, Вг | Растворы |
| Подвижные | Са, Na. Mg, Sr, Ra, F | Растворы |
| Слабоподвижные | К, Ba, Pb, Li, В, Cs, Те, Si, P, Sn, Ge | Особенно в форме растворов |
| Подвижные и слабоподвижные в окислительной среде | Zn, Ni, Cu, Pb, Cd, Hg, Ag | Энергичная миграция в кислых растворах и слабая подвижность в нейтральных и щелочных растворах, особенно в форме катионов |
| Инертные в восстановительной среде | U, V, Mo, Se, Ra | Энергичная миграция в кислых и щелочных растворах, особенно в форме анионов |
| Подвижные и слабоподвижные в восстановительной среде и инертные в окислительной среде | Fe, Mn, Co | Умеренная миграция |
| Слабоподвижные в большинстве сред | Al, Ti, Zr, Cr, Mb, Ga, Th, Та, W, Bi, Ti, Pd, Rn, Pt, Au, Rh | Миграция слабая, с образованием химических комбинаций, миграция в форме природных металлов |
Геохимические барьеры не остаются вечно неизменными; по мере накопления на геохимических барьерах различных веществ возможно разрушение исходных и образование новых барьеров. Например, первоначально иллювиальный карбонатный горизонт формируется в результате миграции кальция или интенсивного поступления СО2; при этом образуется кальцит. Далее горизонт кальцита выступает как щелочной карбонатный барьер для большой группы элементов: Sr, Pb, Zn, Cd, Со, Сu.
Ряд веществ при миграции теряет подвижность и задерживается на геохимическом барьере. В случае кумулятивного накопления на геохимических барьерах тяжелых металлов даже в слабоподвижных формах нарушается геохимическая устойчивость систем и они загрязняются, но при этом потоки вещества очищаются за счет удержания токсикантов, что ограничивает сферу загрязнения. Например, при поступлении вредных компонентов в составе газопылевых выбросов растительный покров является барьером, задерживающим техно-генные потоки. Загрязненные воды проходят через почву, очищаются от техногенных продуктов, но сама почва в результате загрязняется Компоненты техногенного потока, не задержанные почвой, проникают в нижележащие горизонты, достигают уровня почвенно-грунтовых вод и загрязняют их. Однако в водоносном горизонте и над ним продолжают действовать геохимические барьеры различного типа: сорбционные, восстановительные.
Ландшафтно-геохимические барьеры обладают различной проницаемостью для техногенных потоков и определенной емкостью по отношению к отдельным техногенным компонентам и ко всей их совокупности. Так, емкость щелочного барьера в почвах измеряется количеством карбонатов, способных нейтрализовать кислые техногенные потоки. Емкость сорбционного барьера зависит от емкости поглощения почв и мощности сорбирующего слоя. Емкость восстановительных и окислительных барьеров зависит от количества восстановителей или окислителей, что обусловлено микробиологической активностью среды.
В процессах миграции химических загрязняющих веществ особое место занимает комплексообразование. Многие органические вещества, связывая ионы металлов в комплексы, способствуют их стабилизации и переносу в растворенном состоянии. Путем прямых наблюдений с мечеными соединениями установлено, что миграционная способность железа в форме, связанной с различными органическими компонентами почвенных растворов, на 1-2 порядка и более превосходит миграционную способность ионных форм железа.
Образование металлорганических комплексов иногда имеет положительное биологическое значение, инактивируя избыточные количества активных ионов тяжелых металлов или благоприятствуя растворению труднодоступных, но биологически важных элементов.
На растворимость соединений тяжелых металлов большое влияние оказывает концентрация их в растворе. При очень низкой концентрации микроэлементы не выпадают в осадок при соответствующем изменении реакции среды и при добавлении осадителей. Этот фактор играет важную роль в случае металлов, образующих труднорастворимые соединения при величинах рН и Е, характерных для природных вод. Миграционная способность микроэлементов в форме комплексных соединений не безгранична: она лимитируется устойчивостью самого соединения, возможностью конкуренции со стороны другого элемента, дающего более стойкий комплекс, выпадением в осадок самой комплексной соли.
Растворимые комплексы с органическими соединениями образует большинство металлов. К ним, прежде всего, необходимо отнести комплексы, образуемые гуминовыми веществами и другими органическими кислотами с двух- и трехвалентными металлами. Роль гуминовых веществ в переносе металлов в растворенном состоянии велика. От 50 до 75% марганца, никеля, кобальта переносят в составе органических соединений речные воды.
В настоящее время установлено: что низкомолекулярные соединения неспецифической природы играют небольшую роль в переносе ХЗВ, хотя их набор довольно широк – щавелевая, фумаровая, лимонная и другие кислоты, танины, сахара, аминокислоты и пр.; органические соединения типа фульвокислот образуют комплексы с поливалентными катионами; более высокомолекулярные фракции способны связывать больше поливалентных катионов.
В почвенных растворах и вытяжках обнаружены аминокислоты и кислоты жирного ряда, оксикислоты, полифенолы, фульвокислоты, т.е. весь набор органических соединений, свойственный многим типам природных вод. Все эти вещества содержат функциональные группы, которые участвуют в координационных связях и образовании комплексных и внутрикомплексных соединений. Таким образом, ведущая роль водорастворимых органических веществ в миграции ХЗВ выявлена многими исследователями.
Взаимодействие гумусовых веществ с ионами металлов и другими ХЗВ включает физические (адсорбция, пептизация, коагуляция) и химические (ионный обмен, солеобразование, образование комплексных соединений) процессы. Адсорбция катионов на гуминовых кислотах может быть в некоторых случаях описана уравнением Ленгмюра. Устойчивость образующихся комплексов зависит от ряда факторов и в первую очередь от рН и ионной силы.
Эти же условия определяют связывание тяжелых металлов почвой в целом и ее компонентами. Увеличение рН от 4 до 5,5 ведет к возрастанию сорбции цинка на гидрооксидах железа и алюминия. При рН = 7,5 растворимость цинка увеличивается из-за образования комплексов с органическим веществом. Таким образом, с изменением рН меняется роль почвенных компонентов в сорбции тяжелых металлов. Медь (II) образует комплексы в более широком интервале рН. Добавление меди к почвенному раствору, содержащему цинк, ведет при рН = 5 к снижению сорбции последнего, что является примером взаимного влияния ионов тяжелых металлов.
Кислые почвы поглощают тяжелые металлы из растворов в меньшей степени, чем нейтральные или содержащие карбонаты. В то же время в таких почвах значительное количество меди связывается в комплексные соединения. Кислые почвы имеют меньшее число активных центров, занятых протонами, и ионами алюминия, что снижает возможность адсорбции Сu2+ и Са2+. Карбонатные, богатые кальцием почвы могут в большей степени сорбировать тяжелые металлы. Ион кадмия при этом образует малоустойчивые комплексы. В результате Са2+ более подвижен в почвенном профиле по сравнению с Сu2+. Высокое содержание металлов, приходящееся на единицу органического вещества, в ряде случаев можно объяснить образованием многоядерных комплексов или наличием адсорбированных комплексов, в которых имеется неэквивалентное взаимодействие между органическими лигандами и ионами металлов.
При высоком содержании гумуса интенсивно образуются органометаллические комплексы в коллоидной и растворимой формах, что обусловливает высокую степень их подвижности. При интенсивно промывном режиме и низких значениях рН соединения тяжелых металлов растворяются и переходят в ионную форму. На территориях, где преобладают почвы с высокой степенью засоления, можно ожидать образования труднорастворимых соединений, содержащих тяжелые металлы.
При рН = 6 кадмий присутствует в двухвалентной форме и полностью растворяется в водной фазе при условии, что она не содержит таких связывающих анионов, как фосфат или сульфид.
Образование Cd(OH)2 начинается при рН = 9, достигая максимума при рН = 11. Образование Рb(ОН)2О начинается при рН>9. При рН = 6-10 преобладает Pb(OH)+. При рН = 8,5 и концентрации хлорид-иона более 100,4 моль/л преобладают комплексы CdCl3, CdCl4, PbCl42–. В морской воде, содержащей 10–0,25 моль/л иона Сl– при рН = 8,1-8,2 форма РbОН преобладает над его хлоридными комплексами, а кадмий присутствует в виде CdCl2 и CdCl3. Такая закономерность, установленная на модельных системах, несомненно, может быть справедлива и в природных условиях. В почвенном растворе обнаружено незначительное (<10 мкг/л) содержание комплексов Cd2+ с органическими компонентами, а также хлоридными и сульфатными лигандами (CdCl2, CdCl3, CdCl4, CdSO4). Все эти комплексы либо заряжены отрицательно, либо нейтральны, причем ион Cd2+ обнаруживается весьма редко. Отмечена возможность присутствия меди в гуминовых кислотах и фульвокислотах в форме комплекса медь-порфиринового типа. Гуминовые вещества активно реагируют с катионами, оксидами и гидроксидами металлов, образуя химически разнообразные и биологически устойчивые соединения.
Формы миграции тяжелых металлов в природных водах и, в частности, в почвенных, многообразны. Взвешенные и коллоидные формы соединений входят в состав почвенных гранулометрических фракций, а истинно растворенные извлекаются в составе водных вытяжек из почв.
Таким образом, для вещественного состава водных вытяжек характерно следующее: 1) водные вытяжки содержат большой набор органических соединений различного состава; 2) вещества, содержащиеся в водных вытяжках, способны образовывать комплексы с тяжелыми металлами; эти комплексы могут иметь в природных условиях различный знак заряда; 3) на комплексообразование оказывает сильное влияние рН, конкурентное комплексообразование, ионная сила раствора, состав лигандов, наличие и состав неорганических анионов.
Миграция химических загрязняющих веществ в природных, грунтовых водах, в почвенных растворах. Сложность химического состава природных вод обусловлена и тем, что один и тот же элемент может находиться в воде в разных формах в зависимости от степени растворимости его соединений, валентного состояния, способности и комплексообразованию и других химических свойств. Так, железо в зависимости от рН и окислительно-восстановительного потенциала встречается в природных водах в двух- и трехвалентном состояниях. Для каждого из валентных состояний характерны гидрологические моно- и полиядерные формы: для Fe(III) – это [Fе(ОН)3]0; [Fe(OH)2]+; [Fе(ОН)]2+; [Fе2(ОH)3]3+; [Fе2(ОH)2]4+; [Fe2(ОH)]5+; Fe3(ОH)2]7+; дляFe(II) – [Fe(OH)2]0; [Fе(ОН)]+; [Fе2(ОH)3]–. Железо образует прочные комплексы с органическими веществами природных вод.
Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод. Перенос электрона в Red-Ox-процессе сопровождается переносом протона, обуславливая тем самым для реакций, протекающих в водном растворе, жесткую взаимосвязь между окислительно-восстановительным и кислотно-основным равновесием.
Например, если ион Fe2+ отдает электрон, то выделяются три иона водорода, что в результате приводит к образованию Fe(OH)3¯ и увеличению концентрации H+ в растворе.
[Fe(H2O)6]2+ ⇄ Fe(OH)3 + 3H2O + 3H+ + 
Протекание этой реакции объясняет кислый характер шахтных вод и образование “ржавчины” в местах выхода на поверхность подземных вод, содержащих ионы Fe2+.
Величина окислительно-восстановительных реакций, протекающих с участием H+ или OH–, зависит от pH раствора.
Эта зависимость может быть представлена в виде диаграммы p – pH или Eh – pH.
– pH или Eh – pH.
Диаграммы эти идентичны, за исключением оси ординат, масштаб которой изменяется в соответствии с уравнением
p = FEh/(2,3RT)
= FEh/(2,3RT)
При T = 298 К, Eh = 0,0591p
Eh – Ox-Red потенциал, определяется по уравнению Нернста

Недостаток использование Eh в качестве переменной состоит в том, что наклоны границ устойчивости зависят от температуры, что удается избежать в случае, когда переменной является p .
.
Принципы построения диаграммы p – pH. Ox-Red реакция, определяющая пределы существования (устойчивости) воды.
– pH. Ox-Red реакция, определяющая пределы существования (устойчивости) воды.
Реакция окисления H2O:
2H2O ® O2 + 4H+ + 4
Реакция восстановления H2O:
2H2O + 2 ® H2 + 2OH–
® H2 + 2OH–
Эти пределы определяют пределы изменения p в воде. pH оказывает влияние на характеристики обеих реакций.
в воде. pH оказывает влияние на характеристики обеих реакций.
Зависимость p – pH для окислительной границы устойчивости воды можно исходя из следующих рассуждений.
– pH для окислительной границы устойчивости воды можно исходя из следующих рассуждений.
Реакцию окисления воды запишем в следующем виде:
1. ¼O2 + H+ +  ® ½H2O
® ½H2O
2. 
где  – активность свободных электронов.
– активность свободных электронов.
В качестве граничных условий при описании пределов устойчивости воды давление кислорода 101 кПа (1 атм), при этом Ркисл = 1. Активность воды также принимается равной 1. Уравнение принимает вид:
3. 
Прологарифмируем и возьмем отрицательный логарифм
4. p = lg K – pH
= lg K – pH
Величину логарифма константы равновесия этой реакции легко найти из значения энергии Гиббса образования молекул воды, ΔG образования кислорода, ионов водорода и электронов принимаются равными нулю, поэтому
lg K = -½ΔGH2O/2,3RT = 20,8
При Ркисл. = 1 атм
5. p = 20,8 – pH
= 20,8 – pH
В общем случае:
6. p = 20,8 + ¼ lg РО2– pH
= 20,8 + ¼ lg РО2– pH
Зависимость p –pH для восстановленной границы устойчивости
–pH для восстановленной границы устойчивости
воды:
1. H+ +  ® ½ 2H2
® ½ 2H2
2. 
3. p = lg K + ½ lg РH2– pH
= lg K + ½ lg РH2– pH
Т.к. ΔG реакции (1) равно нулю, это значение логарифма константы равновесия этой реакции равно нулю. При граничных условиях
Рводор. = 1 атм, поэтому
4. p = –pH
= –pH
Т.к. природные воды обычно находятся в контакте с воздухом, в котором парциальные давление кислорода и водорода меньше 1 атм, Ox-Red потенциалы будут находится в интервале значений, определяемых уравнениями:
p = 20,8 – pH
= 20,8 – pH
p = –pH
= –pH
На диаграмме p – pH (Eh – pH)
– pH (Eh – pH)
1. Каждый отрезок прямой отвечает зависимости p от pH для определенной реакции.
от pH для определенной реакции.
2. Если p не зависит от pH отрезки параллельны оси абсцисс.
не зависит от pH отрезки параллельны оси абсцисс.
3. Вертикально расположенные отрезки не связаны с протеканием ОВР, обычно они определяют границы областей фазовых переходов.
4. Если p определяется величиной pH отрезки расположены наклонно. Тангенс угла наклона определяется отношением количества ионов водорода и электронов, принимающих участие в данной реакции.
определяется величиной pH отрезки расположены наклонно. Тангенс угла наклона определяется отношением количества ионов водорода и электронов, принимающих участие в данной реакции.
5. Диаграммы строятся при определенных значениях концентраций реагирующих компонентов и изменение концентраций приводит к изменению границ соответствующих областей.
6. ОВР в реальных природных водах протекают при участии бактерий, в каждой из ОВР участвует свой тип бактерий и реакции протекают в строгой последовательности. Раньше протекают реакции, обеспечивающие бактериям наибольшую энергию (Eh имеет наибольшее значение).
Поэтому на диаграмме наносятся реакции, которые отвечают более высоким Red-Ox-уровнем.
Задача. Постройте диаграмму p – pH для системы Fe – O – H2O, принимая во внимание лишь следующие превращения Fe2O3 – Fe3O4; Fe3+ – Fe2O3; Fe3+ – Fe2+; Fe2O3 – Fe2+; опишите области устойчивого существования соединений железа при различных значениях pH.
– pH для системы Fe – O – H2O, принимая во внимание лишь следующие превращения Fe2O3 – Fe3O4; Fe3+ – Fe2O3; Fe3+ – Fe2+; Fe2O3 – Fe2+; опишите области устойчивого существования соединений железа при различных значениях pH.
Все области устойчивого существования соединений железа в рассматриваемой системе должны находится между границами, определяющими устойчивое состояние воды.
1. Рассмотрим границы Fe2O3 – Fe3O4
Уравнение, описывающее это превращение
1.1. 3Fe2O3 +2 +2Н+ ⇄ 2Fe3O4 + H2O
+2Н+ ⇄ 2Fe3O4 + H2O
Если Fe2O3 и Fe3O4 не содержат примесей, примем их активность
равной 1.
Константа равновесия реакции имеет вид:
1.2. 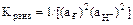
Прологарифмируем уравнение и выразим значение p .
.
lg K = 2p +2pH
+2pH
1.3. p = ½lg K – pH
= ½lg K – pH
На диаграмме эта граница является прямой с тангенсом наклона к оси абсцисс, равным –1.
Точка пересечения с осью ординат задается величиной константы равновесия, которую можно определить, предварительно рассчитав ΔG° реакции, описывающей данную границу:
 = –30,88 кДж/моль
= –30,88 кДж/моль
lg Kравн = –ΔG°/2,3RT = 30,88×103/2,3×8,31×298 = 5,42
Уравнение, определяющее границу, имеет вид:
1.4. p = 2,71 – рН
= 2,71 – рН
2. Рассмотрим границы Fe3+ – Fe2O3
Уравнение, описывающее это превращение:
2.1. Fe2O3 + 6H+ ⇄ 2Fe3+ +3H2O
2.2. Константа равновесия этого процесса:
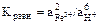
2.3. 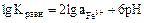
На диаграмме эта граница является прямой, параллельной оси p . Эля того, чтобы представить графически эту границу между растворимой и не растворимой формами трехвалентного железа, необходимо сделать произвольный выбор величины aFe3+.
. Эля того, чтобы представить графически эту границу между растворимой и не растворимой формами трехвалентного железа, необходимо сделать произвольный выбор величины aFe3+.
Обычно для объектов окружающей среды активность растворенной формы железа оценивают значением 10–6. Тогда
2.4. pH = 1/6 lg Kравн +2
Исходя из аналогичных рассуждений, проделанных раннее
lg Kравн = –2,23, тогда
2.5. pH = 1,63
3. Рассмотрим границы Fe3+ – Fe2+
Граница задается уравнением:
3.1. Fe3+ +  ⇄ Fe2+
⇄ Fe2+
3.2. Константа равновесия этого процесса:
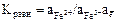
Прологарифмируя получим 
3.3. 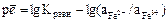
3.4. 
На диаграмме граница является прямой, параллельной оси pH.
Соотношение активностей  обычно в таких случаях принимается равным 1, но нужно иметь в виду, что выше этой границы могут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+.
обычно в таких случаях принимается равным 1, но нужно иметь в виду, что выше этой границы могут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+.
4. Рассмотрим границы Fe2O3 – Fe2+
Граница задается уравнением:
4.1. Fe2O3 + 2 + 6H+ ⇄ 2Fe2+ + 3H2O
+ 6H+ ⇄ 2Fe2+ + 3H2O
4.2. Константа равновесия этого процесса:

4.3. 
Вновь встает вопрос о выборе значения  . Если принять
. Если принять 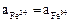 , то К вычислять не нужно, т.к. граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона равным –3, проходящей через точку пересечения границ Fe2O3 – Fe3+ и Fe3+ – Fe2+.
, то К вычислять не нужно, т.к. граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона равным –3, проходящей через точку пересечения границ Fe2O3 – Fe3+ и Fe3+ – Fe2+.
При построении диаграмм рекомендуется вычислить Кравн и проверить, пройдет ли новая граница через точку пересечения двух других.
Если три границы не встретились в одной точке, это будет свидетельствовать об арифметической ошибке.
Неточности в величинах энергии Гиббса привели бы к ошибочному положению точки пересечения, но точка в любом случае должна быть одна.
5. Рассмотрим границы Fe3O4 – Fe2+
Граница задается уравнением:
5.1. Fe3O4 + 2 + 8H+ ⇄ 3Fe2+ + 4H2O
+ 8H+ ⇄ 3Fe2+ + 4H2O
5.2. Константа равновесия процесса:
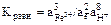
5.3. 
Вычисление Кравн не является необходимым, поскольку известен тангенс угла наклона (-4) и общая точка – пересечение границ Fe2O3 – Fe2+ и Fe3O4 – Fe2+.
Пунктирной линией обозначены границы, соответствующие активности  моль/л.
моль/л.
1. ¼O2 + H+ +  ® ½H2O
® ½H2O
2. 3Fe2O3 +2 +2Н+ ⇄ 2Fe3O4 + H2O
+2Н+ ⇄ 2Fe3O4 + H2O
3. Fe2O3 + 6H+ ⇄ 2Fe3+ +3H2O
4. Fe3+ +  ⇄ Fe2+
⇄ Fe2+
5. Fe2O3 + 2 + 6H+ ⇄ 2Fe2+ + 3H2O
+ 6H+ ⇄ 2Fe2+ + 3H2O
6. Fe3O4 + 2 + 8H+ ⇄ 3Fe2+ + 4H2O
+ 8H+ ⇄ 3Fe2+ + 4H2O
7. H+ +  ® ½ 2H2
® ½ 2H2
Анализируя полученную диаграмму, можно сделать следующие выводы.
1. Fe3+ является преобладающей формой только в крайне кислых средах, напр. в дренажных водах рудников;
2. В щелочных средах железо должно быть нерастворимым при любых значениях p .
.
3. В нейтральной и слабокислой средах железо должно быть нерастворимым в окислительных средах и растворимым (в форме Fe2+) в восстановительных средах.
Состав природных вод. Принято совокупность компонентов, входящих в состав природных вод, условно делить на пять групп:
1) главные ионы, или макрокомпоненты, к которым относятся ионы Сl–, SO42–, НСО3–, СО32–, Na+, K+, Mg2+, Са2+; 2) растворенные газы (O2, N2, CO2, H2S и др.); 3) биогенные элементы (соединения азота, фосфора, кремния); 4) органические вещества. 5) микроэлементы.
Такое деление химического состава природных вод условно, поскольку многие элементы необходимы организмам, как упомянутые биогенные элементы. Ниже рассмотрены наиболее важные группы компонентов.
Главные ионы. К главным ионам, или макрокомпонентам природных вод относятся элементы, характеризующиеся высокими значениями кларков и хорошей растворимостью их соединений в воде. В некоторых случаях (это характерно для морских и океанических вод) к группе главных ионов относятся также Вг– и HS–.
Макроэлементы в природные воды поступают при выщелачивании горных пород и почв, а также в результате производственной деятельности человека. Растворение горных пород значительно возрастает под воздействием кислых вод, особенно болотных с высоким содержанием органических веществ. При этом переход катионов из породы в раствор обусловлен не только обменными реакциями, но и комплексообразованием.
Почвы сильно влияют на химический состав фильтрующихся вод: повышается минерализация маломинерализованных атмосферных осадков, изменяется ионный состав воды, возрастает способность растворов растворять минералы. При взаимодействии природных вод с почвами катионы поглощающего комплекса почв обмениваются на эквивалентное количество других катионов, содержащихся в воде.
Хорошая растворимость многих природных соединений макрокомпонентов обусловливает их миграцию преимущественно в ионной форме. Простые ионы, как правило, свойственны маломинерализованным водам. Так. в миллимолярном растворе гидрокарбоната кальция лишь около 3,65% ионов Са2+ и НСО3–, связано в ионные пары, а остальные находятся в виде простых ионов. Комплексообразование для макрокомпонентов природных вод сравнительно мало характерно, поскольку все они – слабые комплексообразователи.
Биогенные элементы. В группу биогенных элементов кроме азота, фосфора и кремния часто включают железо и серу, поскольку они необходимы живым организмам, а их содержание в некоторых случаях достигает нескольких миллиграммов на 1 л воды. Наиболее важные источники поступления биогенных элементов в природные воды разделяют на две большие группы: внешние и внутренние:
1) внешние источники обеспечивают поступление биогенных веществ в водоемы с речным стоком, атмосферными осадками, промышленными, хозяйственно-бытовыми и сельскохозяйственными сточными водами;
2) внутренние источники обеспечивают накопление биогенных элементов в результате процессов, протекающих в самих водоемах; значительная роль в этом принадлежит первичной продукции органического вещества: поступлению из залитого ложа водохранилищ в первые годы их существования, минерализации древесной, луговой и высшей водной растительности и отмершего планктона, а также донным отложениям.
Углерод. Современные исследования глобального цикла углерода включают по возможности более точные оценки запасов почвенного углерода и в частности, углерода антропогенных источников. Наиболее активное сведение лесов под сельскохозяйственные угодья в настоящее время происходит в тропиках, так что тропические почвы, по-видимому, оказываются основным источником ежегодных поступлений углерода в атмосферу (до 60% от поступлений углерода за счет сжигания ископаемого топлива). Динамика и балансы почвенного органического вещества специально исследуются на ключевых участках с известными недавними изменениями видов использования территории прямыми и косвенными методами, в том числе путем изучения изменений изотопного состава углерода в почвенном органическом веществе, например, при смене естественной растительности сельскохозяйственными культурами (рис. 8.1).

Рис. 8.1. Глобальный цикл углерода
Оксиды углерода и газообразные углеводороды поступают в атмосферу как за счет промышленных предприятий и коммунального хозяйства, так и за счет эмиссии этих соединений целинными и пахотными почвами.
Эмиссия СО2 из почвы в атмосферу колеблется очень сильно в зависимости от особенностей почв и климатических условий, в т.ч. от содержания органического вещества в почве, влажности, температуры. Скорость выделения СО2 растет с температурой и, согласно ряду исследований, по экспоненциальной зависимости. Показано, что из некоторых японских почв скорость выделения СО2 достигала 3 г (в пересчете на углерод в сутки с площади 1 м2. Для некоторых почв тропических лесов Юж. Америки найдены уровни порядка 1,5×1014 молекул/(см2×с).
Наибольшая эмиссия СО2 при прочих равных условиях характерна для тропических почв. Балансовые расчеты показали, что в тропических почвах значительная (если не преобладающая) часть выделяющегося СО2 обусловлена корневыми выделениями, а меньшая часть – разложением органического вещества.
Известно, что уровень содержания СО2, обычный для атмосферы, т.е. около 0,03% (по объему), не обеспечивает максимальную продуктивность зеленых растений. Положительное влияние на развитие корней и на прирост наземной биомассы оказывает увеличение концентрации СО2 до 2%, однако при содержании СО2 около 8% уже наблюдается ингибирующий эффект.
Таким образом, некоторое дополнительное поступление СО2 в атмосферу может играть положительную роль, но все же большую экологическую опасность при этом представляет «парниковый» эффект.
Органические вещества – одна из самых сложных по качественному составу групп соединений, содержащихся в природных водах, она включает органические кислоты, фенолы, гумусовые вещества, азотсодержащие соединения, углеводы и т.д.
Природные воды содержат органические вещества в сравнительно невысоких концентрациях. Средняя концентрация органического углерода в речных и озерных водах редко превышает 20 мг/л. В морских и океанических водах содержание Сорг еще более низкое. Содержание белковоподобных веществ, свободных аминокислот и аминов колеблется в пределах 20-340, 2-25 и 6-200 мкг азота на 1 л соответственно.
Концентрация органических кислот и сложных эфиров редко превышает пределы 40-200 и 50-100 мкг/л. Содержание углеводов несколько выше и нередко достигает единиц миллиграммов в 1 л. Значительную часть органического вещества природных вод составляют гумусовые вещества: гуминовые кислоты и фульвокислоты. Особенно богаты гуминовыми веществами воды северных районов страны, где концентрация их часто составляет единицы и десятки миллиграммов на 1 л. В морских и океанических водах среднее содержание гумусовых веществ ниже и редко превышает 3 мг/л.
По происхождению органические вещества природных вод делят на две большие группы: 1) продукты биохимического распада остатков организмов, населяющих водоем (главным образом планктон), – это вещества автохтонного происхождения; 2) органические вещества, поступающие в водоемы извне с речным стоком, атмосферными осадками, промышленными, хозяйственно-бытовыми и сельскохозяйственными сточными водами – аллохтонные вешества. Особое место в этой группе занимают гумусовые вещества почв, торфяников, лесных подстилок и других видов природных образований, включающих остатки растений. Нередко в водах рек с болотным питанием гумусовые вещества доминируют среди других соединений.
Органические вещества природных вод могут находиться в состоянии истинных растворов. коллонп,ов и взвешенных грубых части (суспензии). Коллоидная скорма миграции наиболее характерна для природных вол зоны гипергенеза. богатых высокомолекулярными гумусовыми веществами. Однако часть окрашенных органических соединений – фульвокислоты и некоторые формы гуминовых кислот – могут быть в состоянии истинных растворов,
Для природных вод характерна миграция органического вещества в виде взвесей, например детрита, состоящего из мельчайших органических и неорганических остатков, образующихся при распаде погибших организмов. Несмотря на относительно невысокое содержание органических соединений, они играют важную роль в физико-химических и биохимических процессах, протекающих в природных водах и в значительной степени определяющих особенности химического состава вод и биологическую продуктивность водоемов.
Особое место среди этих явлений занимает комплексообразование. Многие органические вещества, связывая ионы металлов в комплексы, способствуют их стабилизации и переносу в растворенном состоянии - Образование органо-металлических комплексов имеет положительное биологическое значение, инактивируя избыточные количества ионов тяжелых металлов или благоприятствуя растворению труднодоступных, но биологически важных элементов. Благодаря наличию в составе макромолекул гумусовых веществ большого набора функциональных групп вполне закономерна возможность связывания ими в комплексы. ионов различных металлов.
Полициклические ароматические углеводороды. Попадающие в почву и природные воды ПАУ могут мигрировать, связываться твердыми фазами и взвесями, трансформироваться в другие соединения. Из ароматических углеводородов только бензол может диффундировать в пористой почвенной среде в газообразной форме, но его коэффициенты диффузии невелики и при 20°С близки к 9×10–6 м2/с. Закономерности адсорбции ПАУ как неполярных гидрофобных соединений различными минеральными и органическими частицами полностью не изучены. Сорбционная способность в значительной мере зависит от уровня растворимости ароматического соединения.
Особое значение для оценки уровня опасности загрязнения природных сред ароматическими углеводородами имеет скорость их трансформации, разложения или потерь из водных и почвенных сред. Для оценки скорости потерь или устойчивости ПАУ в почве проводили специальные лабораторные опыты. Обычно это инкубационные опыты, когда к почве добавляют различные количества ПАУ (индивидуальных или в смеси), инкубируют при контролируемых температурах и влажности, а затем периодически определяют остаточные количества ПАУ в среде, используя любые подходящие методы.
Такого рода наблюдения не говорят однозначно об исчезновении ПАУ из почвы; возможна их.частичная трансформация и частичная адсорбция твердыми фазами. В последнем случае токсичность ПАУ снижается, но может происходить их постепенное накопление со временем и проявление токсичных эффектов при достижении определенного уровня содержания.
В числе механизмов разрушения ПАУ особенно важны два: трансформация конкретными видами микроорганизмов и фотохимическая деструкция. Было показано, что в почвах, загрязненных нафталином, присутствуют бактерии рода Pseudomonas, которые могут использовать нафталин как единственный источник углерода. Катаболизм нафталина бактериями этой группы включает стадии последовательного образования сначала дигидро- и диоксинафталинов, затем через ряд промежуточных продуктов – салицилового альдегида и салициловой кислоты, а в конце цепи трансформации появляются фумаровая и пировиноградная кислоты.
Высокая устойчивость ПАУ обычно рассматривается как неблагоприятное свойство, поскольку по этой причине они длительно сохраняются в почвах. Ускорить трансформацию полициклических ароматических углеводородов, в частности бензпирена, удается при их облучении ультрафиолетовым светом с длиной волны около 300 нм или природным солнечным светом. ПАУ легко поглощают энергию электромагнитных колебаний и через 1,5 ч облучения количество бензпирена снижается на 50–60%. Трансформация ускоряется в несколько раз в присутствии окислителей, например пероксида водорода. Эта реакция интересна еще и потому, что природные гуминовые вещества также быстро подвергаются деструкции при фотооблучении и для поверхностных слоев почвы, которые обычно наиболее сильно загрязнены ПАУ, такой процесс может иметь существенное значение.
Среди большого спектра соединений ароматической природы ПАУ наиболее устойчивы в почвах. Менее устойчивы, но способны образовывать в почвах устойчивые продукты их трансформации – анилин, индолы; наименее устойчивы фенолы и их производные, относящиеся к группе веществ, обладающих высокой фитотоксичностью.
Фенолы. Фенолы поступают в биоценозы также различными путями, в том числе – с промышленными стоками коксохимического производства, некоторых химических производств. Особую важность в последнее время вопросу о превращениях фенолов придает открытое совсем недавно превращение фенолов в диоксины.
Фенолы содержатся в осадках городских сточных вод и могут выщелачиваться оттуда атмосферными осадками, попадая с жидким стоком в почвы и водоемы. Скорость разложения фенолов в почвах довольно велика: при исходных дозах 500 мг/кг фенол не обнаруживался в почвах уже через 6 сут, крезолы через 7-11 сут. Скорость трансформации составляет примерно 40-120 мг в сутки. Наиболее вероятные механизмы реакции разложения связаны с деятельностью микроорганизмов; так, установлены реакции окисления, катализируемые фенолоксидазойПо другим данным наибольшая скорость трансформации в почве найдена для о -кре-зола – 62 мг/(кг × сут), наименьшая – для пентахлорфенола (1,0 мг/кг × сут). Скорость разложения тесно связана с типом и положением заместителей в фенольном кольце: наиболее устойчивы вещества с заместителями в мета -положении по отношению к фенольному гидроксилу, а метальные производные менее устойчивы, чем хлорфенолы. Характерно, что менее токсичные фенолы разлагаются быстрее высокотоксичных, что прямо указывает на биологический характер процесса разложения. Продукты окисления могут связываться глинистыми минералами или инкорпорироваться гуминовыми веществами.
Аналогичные механизмы установлены и для большой группы ксе-нобиотиков, в том числе для пестицидов (особенно для производных фенолуксусной кислоты), хлоранилинов; сходным путем трансформируются феноксикислоты – ванилиновая и сиреневая. Например, установлено, что смесь диметилфенола и сиреневой кислоты в присутствии группы грибных ферментов (лакказы) образует ряд продуктов: димеры, тримеры и тетрамеры, включающие окисленные исходные вещества. Характерно, что такие продукты не образуют полимеров из-за блокирования концов димерных цепочек метальными и метоксильными группами.
Отсутствие фенолов в почве, которое обнаруживается по аналитическим данным, не всегда связано с их разложением или трансформацией. Как и для многих других органических соединений, возможна адсорбция фенолов глинистыми минералами, обратимая или необратимая, в частности в зависимости от характера алкильных заместителей в фенольном кольце и состава катионов, насыщающих глинистые минералы. Для большинства фенольных соединений сорбция (или хемосорбция) наиболее хорошо выражена для глин, насыщенных ионами железа, меньше сорбируют Al-глины, еще меньше – глины, насыщенные медью или ионами кальция.
Влияние поглощенных (обменных) катионов на сорбцию фенолов явно связано со способностью последних образовывать с катионами различных металлов комплексные соединения. Если в образовании таких соединений участвуют свободные катионы почвенного раствора, то могут возникать растворимые комплексы и в таком виде многие металлы, в том числе переходные (или тяжелые металлы), активно мигрируют в почвенном профиле и в ландшафте. Почва при этом освобождается от загрязнения тяжелыми металлами, хотя природные воды испытывают вторичное загрязнение. В этом также проявляется противоречивость многих почвенно-химических процессов.
Миграция и трансформация нефти. Ультрафиолетовая составляющая солнечной радиации существенно ускоряет деструкцию компонентов нефти, однако с экологической точки зрения этот процесс опасен из-за образования продуктов распада, как правило, сильно токсичных для гидробионтов. После испарения наиболее летучих компонентов процесс разрушения нефтяной пленки замедляется, так как остатки подвергаются биологическому и химическому разрушению.
Биохимическое разложение основной массы разлитой нефти протекает очень медленно, т.к. в природе не существует какого-либо определенного вида микроорганизмов, способного разрушить все компоненты нефти. Бактериальное воздействие отличается высокой селективностью и полное разложение нефти требует воздействия многочисленных бактерий разных видов, причем для разрушения образующихся промежуточных продуктов требуются свои микроорганизмы. Легче всего протекает микробиологическое разложение парафинов. Более стойкие циклопарафины и ароматические углеводороды сохраняются в океанской среде гораздо дольше.
Тяжелые фракции нефти не разлагаются и не осаждаются в морской воде. Они образуют с ней стойкие эмульсии, чему способствует присутствие в водоемах взвешенных органических частиц, бактерий и планктона. Со временем эмульсии коагулируют с образованием смолистых сгустков, которые плавают на поверхности воды и выбрасываются приливом на сушу, загрязняя побережья, пляжи, портовые сооружения.
Скорость процессов химического окисления нефти в водной среде составляет всего 10-15% скорости биохимического окисления. Особенно опасны попадания больших объемов нефти в воды высоких широт. При низких температурах разложение нефти идет еще медленнее и нефть, сброшенная в арктические моря, может сохраняться до 50 лет, нарушая нормальную жизнедеятельность водных биоценозов.
Трансформация пестицидов. При внесении в почву пестициды подвергаются многочисленным влияниям биотического и небиотического характера, которые определяют их дальнейшее поведение, трансформацию и в конечном счете минерализацию. Направление и скорость превращения молекул пестицидов обусловлены химической природой действующего вещества, типом почвы, состоянием и активностью ее биоты, характером внешних воздействий на почвенный покров (агротехнические и мелиоративные приемы и т.п.). Все пестициды являются ядовитыми веществами не только для определенной формы жизни, но и для полезных насекомых и микроорганизмов, животных, птиц и человека. В идеальном случае пестицид, оказав требуемое воздействие на вредителя, должен был бы сразу разрушиться, образовав безвредные продукты разложения. Однако большинство пестицидов представляют собой устойчивые трудноразлагаемые соединения, у которых непосредственно используется 4-5% внесенного количества, а остальная масса рассеивается в агроэкосистеме, попадая в почву, растения и другие компоненты окружающей среды, что создает сложные экологические проблемы.
В зависимости от способности сопротивляться процессам разложения пестициды подразделяют на слабостойкие (сохраняются в окружающей среде 1-12 недель), среднестойкие (сохраняются 1-18 мес.) и очень стойкие (сохраняются два года и более). Очевидно, что слабостойкие пестициды в окружающей среде практически не накапливаются.
Под устойчивостью пестицида понимают его способность определенное время сохраняться в почвах, измеряемую периодом полураспада, т.е. временем, необходимым для разрушения 50% внесенного в почву пестицида (табл. 8.2).
Таблица 8.2. Период полураспада хлорорганических инсектицидов в почве
| Инсектицид | Период полураспада, годы | Инсектицид | Период полураспада, годы |
| Гептахлор | 7-12 | Хлоран | 2-4 |
| Токсафен | ГХЦГ | ||
| Альдрин | 1-4 | Иэодрин, эндрин | 4-8 |
| Дильдрин | 1-7 |
Серосодержащие пестициды разлагаются за счет окислительно-восстановительных реакций; разложение ряда пестицидов связано с присутствием в почве свободных радикалов (разложение амитрола) или избытка нитратов (переход атразина в N-нитроатразин). Однако преобладающую роль в разложении пестицидов играют почвенные микроорганизмы.
Продолжительность биотического разложения пестицидов может колебаться от нескольких дней до нескольких месяцев и даже десятков лет. Фосфорорганические соединения и производные карбамидной кислоты разлагаются сравнительно быстро, менее чем за 5 мес, и даже при больших масштабах использования не образуют токсичных метаболитов. Напротив, срок разложения хлорорганических соединений может достигать 2-3 лет, а в ряде случаев 10 лет и более. Наблюдения показывают, что в течение первого года после внесения 80-100% хлорорганических биоцидов сохраняется в почве и лишь мигрирует вниз по почвенному профилю. Более того, некоторые препараты этого типа под воздействием почвенных микроорганизмов активируются: так, 2,4-дихлорфеноксимасляная кислота преобразуется в известный гербицид 2,4-Д, обладающий гораздо более сильными фитотоксичными свойствами. Рядом исследований установлено, что хлорорганические инсектициды (альдрин, дильдрин, линдан, гептахлор) медленно разлагаются в хорошо аэрированных почвах и активно – в почвах с недостатком кислорода, т.е. в анаэробных условиях. Поэтому для ускорения разложения остаточных количеств некоторых инсектицидов в почвах нередко используют затопление.
Почва является основным аккумулятором пестицидов, которые накапливаются в ней в результате адсорбции их молекул почвенными коллоидами. Чем выше доза внесения и устойчивее сам токсикант, тем длительнее он сохраняется и тем опаснее его последействие. Так, в Канаде и США были отмечены токсичные концентрации гербицидов в сахарной свекле, выращиваемой после обработанной ими кукурузы. Одновременно в почве протекают и процессы разложения молекул пестицидов, характер и скорость которых зависят от химической природы препаратов, а также от водно-физических характеристик и химического состояния почвы.
Различают небиотическое и биотическое разложение пестицидов в почве. Небиотическое разложение протекает за счет гидролиза (хлорорганические инсектициды, триазиновые гербициды и т.п.), на скорость которого оказывают существенное влияние рН среды, температура и влажность почвы, ее минеральный состав. Оно осуществляется также за счет фотолиза пестицидов под действием солнечной радиации, что особенно важно для токсикантов, вносимых на поверхность почвы.
В настоящее время разработаны математические методы, позволяющие прогнозировать опасность накопления того или иного пестицида в агроэкосистеме, и установлена шкала, позволяющая оценить токсичность пестицида в баллах.
Азот. В природных водах азот находится в виде ряда неорганических и разнообразных органических соединений. К неорганическим формам этого элемента относятся аммоний, нитриты и нитраты – все хорошо растворимые. Белковоподобные соединения, полипептиды, гумусовые вещества, аминокислоты, амины, мочевина – далеко не полный перечень азотсодержащих органических вещества которые присутствуют в воде во взвешенном состоянии (остатки организмов), в виде коллоидных и истинных растворов. Между неорганическими и органическими соединениями азота постоянно осуществляются взаимные переходы. Повышение содержания нитратов и нитритов в воде свидетельствует о загрязнении воды. В чистых водах нитрит-ионы аналитически не обнаруживаются.
Трансформация соединений азота в почвах включает следующие процессы (рис. 8.2.): 1) фиксация атмосферного азота свободноживущими и клубеньковыми бактериями; 2) превращение азотсодержащих соединений органических остатков в гумусовые кислоты; 3) аммонификация органических азотсодержащих соединений; 4) нитрификация; 5) денитрификация и потеря азота в атмосферу; 6) фиксация иона NH4+ глинистыми минералами; 7) вымывание различных соединений азота с внутрипочвенным и поверхностным стоком.
Азот поступает в почву с атмосферными осадками, вымывающими из воздуха NH3 и NO3–. Другим естественным источником азота является его образование при фиксации свободноживущими микроорганизмами и клубеньковыми бактериями, а также при разложении растительных и животных остатков. Существенным источником азота являются техногенные поступления в виде удобрений и многотоннажных промышленных отходов. Органические остатки гумифицируются и аммонифицируются. Ион NH4+ усваивается растениями, вовлекается в процессы гумификации, частично вымывается или фиксируется, а также подвергается нитрификации. Нитрат-ион частично вымывается, поглощается растениями, подвергается денитрификации, замыкая биогеохимический цикл азота.
Уникальность азота среди других биогенных элементов заключается в том, что источником его является атмосфера, а его преобразования и перенос в экосистемах обусловлены почти исключительно круговоротом воды и биотическими процессами.
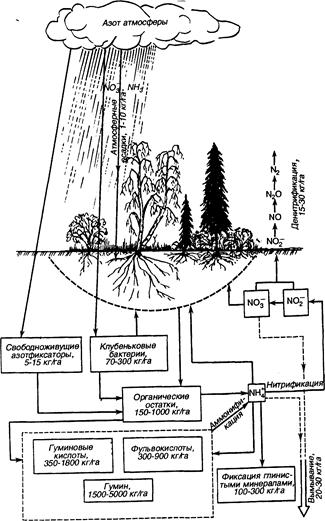
Рис. 8.2. Круговорот азота в биогеоценозе
Поступление азота в экосистему из атмосферы начинается с его контакта с древесным ярусом, где он может потребляться как непосредственно деревьями, так и населяющими их живыми организмами. Азот, не использованный древесным ярусом, поступает в растворах на поверхность почвы (стволовой сток), где в борьбу за него вступают растения, микроорганизмы-деструкторы, или нитрификаторы, превращающие NH4+ в NO3–. Конкуренция за азот между этими группами биоты определяет интенсивность роста растений и степень сохранения азота в лесной экосистеме. В отличие от многих других элементов питания, представленных большими запасами неорганических форм, азот редко накапливается в почве в виде неорганических соединений. Рассмотрим важнейшие процессы, обусловливающие баланс азота в биоценозе.
Аммонификация – процесс разложения органических веществ, протекающий с участием специфических аммонифицирующих микроорганизмов и ведущий к образованию NH3 или NH4+. Ион аммония может быть выщелочен или поглощен в почвенном комплексе или необменно фиксирован трехслойными глинистыми минералами с расширяющейся решеткой. Содержание фиксированного аммония в почвах меняется от 1-2 до 10-12 ммоль/100 г почвы. Аммонификация – первая стадия минерализации азотсодержащих органических соединений.
Следующей стадией является нитрификация: окисление аммиака (аммония) до нитритов и нитратов. Этот процесс протекает в два этапа:
1) окислениеNH3®HNO2 через гидроксиламинNH2OH и гипонитриты (соли азотноватистой кислотыНО–N=N–ОН): NH3 ® NH2OH ® HO–N=N–OH ® ® HO–N=O при участии бактерий Nitrosomonas;
2) окисление N3+ до N5+ HO–N=O ® HO–N(ОН)2  HO–N при участии бактерий Nitrobacter.
HO–N при участии бактерий Nitrobacter.
Нитрификация протекает в почвах в окислительных условиях при величине окислительно-восстановительного потенциала Eh, около 0,4-0,5 В.
Денитрификация осуществляется биологическим путем с помощью бактерий-денитрификаторов Pseudomonas, Micrococcus. В процессе денитрификации осуществляются следующие реакции:
HON ® HO–N = O ® HO–N=N–ОН ® N N=O ® N
N=O ® N N или
N или
NO3– ® NO2 ® NO ® N2O ® N2
Денитрификация наиболее интенсивно протекает в плохо дренированных почвах. Этот процесс, протекающий в корнеобитаемом слое, снижает обеспеченность растений азотом. Газообразные потери азота происходят не только в форме N2, но и в виде ряда оксидов азота. Ежедневная эмиссия N2O из почвы в атмосферу может составлять от следовых количеств до 2-5 мг/м2, причем эмиссия увеличивается во влажные, дождевые периоды при теплой погоде. Общие потери азота за счет денитрификации только в пахотных почвах составляют 1,5 млн. т.
Техногенные выбросы азота в воздушную среду в основном включают оксид азота NO и его диоксид NO2. Мировое количество этих выбросов приближается к 37 млн. т/год без учета отходящих газов нефтепереработки, причем около 97% этого количества приходится на северное полушарие. Максимальное количество оксидов азота дают промышленно развитые страны. Однако в небольших концентрациях NO2 обнаруживается на значительных расстояниях от источников выбросов – над Тихим океаном, в Сев. Атлантике, на Гавайях.
Оксиды азота активно участвуют в фотохимических реакциях, продуцируя озон и азотную кислоту. Однако из-за относительно невысоких концентрацийNO и NO2 в воздухе в настоящее время серьезную проблему представляет не глобальное, а региональное и локальное загрязнение воздуха оксидами азота.
Антропогенез существенно нарушил естественные процессы биологической фиксации и миграции азота, хотя биогенные источники вносят преобладающий вклад в накопление связанного азота в биосфере по сравнению с техногенными (в соотношении порядка 2:1).
В концеXX в. природные циклы азота претерпели существенные изменения. С одной стороны, интенсификация земледелия привела к быстрому снижению запасов гумуса и азота в почвах, с другой – резко возросло поступление в окружающую среду оксидов азота в результате развития транспорта, авиации, теплоцентралей. И наконец, наряду с биогенной фиксацией азота возник и развивается антропогенный, промышленный механизм фиксации азота в виде десятков мли. т азотных удобрений, ассортимент которых в нашей стране и за рубежом постоянно расширяется.
В современную эпоху заметно усилился процесс обогащения окружающей среды соединениями азота. О значительном загрязнении соединениями азота свидетельствует повышение уровня концентрации нитратов в природных водах в 2-4 раза и более.
При взаимодействии нитритов и аминов в живых организмах образуются нитрозамины, являющиеся канцерогенами и способные вызывать нарушения хромосомного аппарата и наследственные уродства. Предельно допустимые количества нитратов для человека, по рекомендации ФАО, не должны превышать 500 мг азота в форме NO3– в день. ВОЗ допускает содержание нитратов в продуктах до 300 мг/кг сырого вещества. Некоторые растительные виды способны накапливать значительное количество нитратов, например семейства Amarantaceae, Chenopodiaceae, Cruciferae, Compositae, Gramineae, Solenaceae.
В настоящее время большую проблему представляет нарушение толщины озонового слоя, на который могут оказывать влияние неполные оксиды азота, вступающие в реакцию окисления N2O до NO2 и использующие кислород озонового слоя.
Разрушение озонового экрана связывают с оксидом азота, который служит источником образования других оксидов, катализирующих фотохимическую реакцию разложения молекул озона. Так, например, молекула озона, поглощая квант света, образует атомарный кислород: О3 + hv ® О + О2.
Основным путем образования оксида азота N2O в почве и воде является процесс денитрификации, хотя некоторые количества его могут возникать при нитрификации, а также при разложении нитрит-иона или гидроксиламина NH2OH в кислых почвах. Таким образом, избыточное вовлечение соединений азота в биосферу представляется весьма опасным. Целесообразно использовать совместное внесение органических и минеральных удобрений, а баланс азота регулировать точным выбором удобрений, времени и способа их внесения.
Фосфор. Фосфор встречается в природных водах в форме органических и неорганических соединений, мигрируя в виде истинных коллоидных растворов и во взвешенном состоянии. Неорганический фосфор представлен соединениями ортофосфорной кислоты Н3РО4, соотношение различных ортофосфатов зависит от рН воды. При рН от 2 до 8 подавляющая часть неорганического фосфора существует в виде Н2РO4--. При рН от 8 до 11-12 преобладает НРО42-.
Значительная часть поступающих в водоем фоефат-ионов сорбируются взвешенными в воде частицами, ибо фосфат-ионы образуют малорастворимые соединения с ионами железа, кальция, алюминия, вследствие чего их миграционная способность уменьшается. Повышается она вследствие процессов комплексообразования (например, смешанно-лигандного), в которых большую роль играют гумусовые вещества.
Вместе с промышленными и бытовыми сточными водами техногенные соединения фосфора могут поступать в почвы и почвенно-грунтовые воды. Особенности миграции и аккумуляции фосфора в биосфере заключаются в практически полном отсутствии газообразных соединений в биокруговороте, тогда как обязательными элементами биокруговорота углерода, азота, серы являются газообразные соединения. Круговорот фосфора представляется простым, незамкнутым циклом. Фосфор присутствует в наземных экосистемах в качестве важнейшей части цитоплазмы; затем органические соединения фосфора минерализуются в фосфаты, которые вновь потребляют корни растений. В процессе разрушения горных пород соединения фосфора поступают в наземные экосистемы; значительная часть фосфатов вовлекается в круговорот воды, выщелачивается и поступает в воды морей, океанов. Здесь соединения фосфора включаются в пищевые цепи морских экосистем.
Часть соединений фосфора теряется в глубинных отложениях.
Частичный возврат фосфора происходит в форме органических удобрений при внесении на поля костно-рыбной муки. Таким образом, ежегодно в круговорот возвращается около 60 тыс. т фосфора. Такое поступление вряд ли может компенсировать расход в 2 млн. т фосфатов, добываемых из залежей и выщелачивающихся при использовании в качестве удобрений.
В настоящее время явно обозначился и сформировался новый процесс антропогенного происхождения – фосфатизация суши, или возрастание общего содержания соединений фосфора в окружающей среде. Процесс этот протекает неравномерно и наиболее интенсивно идет на территории индустриально развитых стран. Если сера, углерод уходят в газообразной форме в атмосферу, то более устойчивые соединения фосфора накапливаются в местах складирования органических отходов, на свалках, полях орошения, что в итоге приводит, как и в случае соединений азота, к эвтрофикации водоемов избытком фосфатов.По даннымЮНЕСКО, признаки эвтрофикации обнаруживаются при содержании фосфора в воде свыше 15 мг/л, а азота – 0,3 мг/л, в то время как биологически чистые воды содержат фосфора сотые и тысячные доли мг/л.
Антропогенные поступления представляют существенную долю в балансе фосфора. Применение удобрений, химическое загрязнение биосферы в целом, эрозионные процессы играют решающую роль в фосфатизации биосферы. Решение противоречивой проблемы – дефицит фосфора и эвтрофикация водоемов – требует разработки комплекса мер, направленных как на максимальное снижение потерь фосфора при переработке, внесении удобрений, так и на недопущение загрязнения окружающей среды соединениями фосфора.
Фосфор активно перераспределяется внутри экосистем за счет почвенных и ландшафтных процессов. Фосфор, участвующий в быстро протекающих круговоротах и имеющий высокую вероятность участия в составе живых организмов, называется биологически активным. Важная роль фосфора в переносе биохимической энергии и биосинтезе влияет и на поведение ряда других элементов-биогенов – С, N, S: они аккумулируют в биосфере в количествах, пропорциональных накоплению биологически активного фосфора.
Вынос фосфора из почв незначителен и идет лишь в течение коротких промежутков времени, однако за весь период почвообразования он достигает значительных объемов. Баланс фосфора может использоваться для расчетов скорости внутрипочвенного выветривания. Старые (т.е. сильно выветрившиеся) почвы чаще встречаются в условиях более влажного и жаркого климата. В процессе выветривания почв фосфор переходит из форм, связанных с кальцием, в железо- и алюмофосфорные соединения, при том, что значительные его количеств
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2802; Нарушение авторских прав?; Мы поможем в написании вашей работы!