
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 15. Электрохимические методы анализа экотоксикантов
|
|
|
|
Вольтамперометрические методы. Методы анализа, основанные на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическими. Вольтамперограмма позволяет одновременно получить качественную и количественную информацию о веществах, восстанавливающихся или окисляющихся на микроэлектроде (деполяризаторах), а также о характере электродного процесса. Метод предложен в 1922 г. чешским электрохимиком Ярославом Гейровским и назван им полярографией. За выдающиеся заслуги в развитии теории и практики метода Я. Гейровскому была присуждена Нобелевская премия. В настоящее время название полярография сохранено в память создателя метода для раздела вольтамперометрии, где индикаторным электродом служит капающий ртутный электрод.
Современная вольтамперометрия – высокочувствительный и экспрессный метод определения неорганических, органических веществ, пригодный для анализа геохимических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ. Для ряда элементов метод конкурентоспособен с атомно-абсорбционной спектроскопией. К другим несомненным достоинствам следует отнести возможность одновременного определения нескольких компонентов (в оптимальных условиях эксперимента до четырех-пяти), а также то, что современный полярограф позволяет получить линейную зависимость тока от концентрации в диапазоне 10–8-10–2 М.
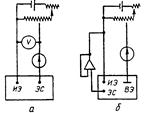
| Рис. 15.1. Двухэлектродная (а) и трехэлектродная (б) ячейки для вольт-амперометрических измерений: ИЭ – индикаторный электрод; ЭС – электрод сравнения; ВЭ – вспомогательный электрод. |
Для регистрации вольтамперограмм применяют двух- и трехэлектродные ячейки. Двухэлектродная ячейка состоит из индикаторного электрода и электрода сравнения (рис. 15.1). Особенностью ячейки является очень большое различие площадей поверхности электродов. Поскольку площадь поверхности микроэлектрода значительно меньше площади поверхности электрода сравнения, плотность тока на микроэлектроде во много раз (десятки тысяч) больше, чем на электроде сравнения. Поэтому налагаемое извне напряжение заметно влияет на микроэлектрод и он поляризуется. Плотность тока на электроде сравнения значительно ниже и обычно полагают, что он не поляризуется (потенциал его остается постоянным). Однако при регистрации вольтамперограмм может протекать довольно заметный ток, поэтому в исследовательских работах, особенно если целью является измерение Е 1/2, рекомендуется применять трехэлектродную ячейку (рис. 15.2.). Кроме указанных электродов она содержит еще вспомогательный электрод (платиновая проволочка или пластинка, слой ртути на дне ячейки), служащий токоотводом от индикаторного электрода. В этом случае ток через электрод сравнения не протекает и он сохраняет потенциал постоянным.
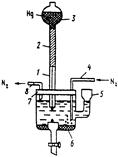
| Рис. 15.2. Простейшая полярографическая ячейка: 1 – стеклянный капиляр; 2 – полиэтиленовый шланг; 3 – груша с металлической ртутью; 4 – стеклянная трубочка с оттянутым концом для ввода азота; 5 – воронка для смены раствора; 6 – донная ртуть (Hg – анод); 7 – полиэтиленовая крышка с отверстиями; 8 – короткая стеклянная трубочка для вывода азота. |
В качестве электродов сравнения в вольтамперометрии применяют чаще других насыщенный каломельный (табулированные величины Е 1/2 обычно дают относительно этого электрода), а также хлоридсеребряный. В рутинных работах, цель которых состоит в определении концентрации, удобно использовать слой ртути на дне ячейки (рис. 15.2), называемый обычно ртутным анодом. Недостатком этого электрода является то, что его потенциал зависит от состава раствора, контактирующего с ним.
Индикаторными электродами служат микроэлектроды из ртути, платины и токопроводящих углеродных материалов (графит, стеклоуглерод). Ртуть – жидкий металл и поэтому электродом может служить либо неподвижно закрепленная капля, либо капли, вытекающие под давлением столба ртути из тонкого капилляра. Такой электрод называется капающим ртутным. Вольтамперограммы, полученные в ячейке с капающим ртутным электродом, называют полярограммами.
В основе метода осциллографической полярографии лежит зависимость очень быстрого нарастания силы тока от мгновенного нарастания приложенного напряжения. Этот вид полярографни обладает значительно большей чувствительностью и разрешающей способностью, чем обычная полярография (табл. 15.1). Современное название этого метода – хроноамперометрия с быстрой линейной разверткой потенциала.
В методе импульсной полярографии постоянное поляризующее напряжение налагают отдельными кратковременными импульсами и протекающий через ячейку постоянный ток измеряют в конце импульса. Этот прием позволяет снизить нижний предел обнаружения вещества до 5×10–7 М.
Таблица 15.1. Сравнение различных разновидностей
полярографии и вольтамперометрии
| Метод | Нижняя граница определяемых содержаний, моль/л | Разрешающая способность, мВ | Разделяющая способность |
| Полярография | |||
| постояннотоковая | 1×10–5 | 10:1 | |
| переменнотоковая | 5×10–8 | 1000:1 | |
| квадратно-волновая | 5×10–8 | 20000:1 | |
| переменнотоковая импульсная | 1×10–8 | 10000:1 | |
| Вольтамперометрия со стационарным электродом | 3×10–7 | 400:1 |
Суть метода пвременнотоковой полярографии заключается в следующем. Изменяющееся по линейному закону постоянное поляризующее напряжение, подаваемое на ячейку, модулируют переменным напряжением. При этом используют либо синусоидальные импульсы переменного напряжения фиксированной частоты (частота сети переменного тока) и небольшой амплитуды (10-50 мВ), либо постоянное напряжение модулируют квадратной формы импульсами переменного напряжения. И в том, и в другом варианте переменнотоковой полярографии чувствительность определения целевых компонентов не более 10–8 М.
Классическая полярография. Дтя регистрации классических полярограмм ячейку с капающим ртутным индикаторным электродом и насыщенным каломельным электродом сравнения (или донной ртутью) через калиброванное линейное сопротивление присоединяют к источнику постоянного напряжения и изменяют потенциал со скоростью 2-5 мВ/с. Для обеспечения достаточно высокой электропроводности в ячейку помещают 0,05-1 М раствор индифферентного электролита (фона). Вид полярограммы (поляризационной кривой в координатах 1-Е) определяется только величиной сопротивления капающего ртутного электрода (рис. 15.3).
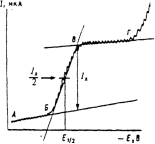
Рис. 15.3. Классическая полярограмма.
Капающий ртутный электрод обладает двумя, присущими только ему, качествами. Во-первых, строгое чередование зарождения, роста и отрыва капель обеспечивают хорошую воспроизводимость площади поверхности и постоянное ее обновление. Поэтому воспроизводимость полярограмм практически абсолютная. Во-вторых, ртутный электрод является почти идеально поляризуемым в очень широком интервале потенциалов, ограниченном в анодной области электродными реакциями окисления ртути (+0,4 В кислой и 0,06 В в щелочной среде), а в катодной – реакциями восстановления иона Н+ (от -1 до -1,5 В в зависимости от концентрации кислоты) или катиона фонового электролита (от -2 В для ионов щелочных металлов до -2,5 В для R4N+). Это позволяет изучать и определять вещества, восстанавливающиеся при очень высоких отрицательных потенциалах, что невозможно на электродах из иных материалов.
Величину предельного тока (Iд), который пропорционален концентрации анализируемого вещества в растворе, находят из полярогра.ммы, представляющей собой кривую зависимости силы тока от приложенного напряжения. Исследуемый раствор, содержащий анализируемые вещества, подвергают электролизу при непрерывно изменяющемся напряжении. При наличии в растворе ионов, способных восстанавливаться или окисляться при определенном потенциале, в момент их разряжения на электроде возникает соответствующая сила тока. Для измерения этого тока в электрическую систему включают гальванометр.
При использовании ртутных электродов катодом служат капли ртути, вытекающие с определенной скоростью (1 капля за 2-7 с) из капилляра диаметром около 1 мм, анодом – слой ртути, имеющий по сравнению с катодом гораздо большую поверхность. Источником тока служит аккумуляторная батарея на 4-6 В. Ток от аккумулятора подается на потенциометр с подвижным контактом, позволяющим подводить к электролизеру напряжение от 0 до 4 В.
У металлической ртути есть два замечательных качества, позволяющие, несмотря на токсичность, использовать ее как незаменимый материал для электрода:
1) ртуть пригодна в качестве материала для электрода (в электрохимической ячейке), способного поляризоваться в широком интервале потенциалов, особенно в катодной области.
2) ртуть – металл жидкий (т. пл. -38°С), поэтому ее можно использовать для изготовления не только стационарного, но и капающего электрода. Из тонкого капилляра ртуть под давлением столба ртути над капилляром вытекает в виде непрерывно растущих и периодически обновляющихся капель. Размер капель хорошо воспроизводится, поэтому и результаты измерений хорошо воспроизводимы. Строгое чередование зарождения, роста и отрыва капель обеспечивает постоянное обновление поверхности электрода.
Размер капли и период капания (время с момента появления капли из капилляра до момента отрыва и падения) зависят от длины и внутреннего диаметра капилляра, а также от высоты столба ртути над капилляром. Известен капающий ртутный электрод с принудительным отрывом капли (с регулируемым периодом ее жизни), снабженный механическим сгряхивателем (молоточек, ударяющий по держателю капилляра через заданные промежутки времени). Это позволяет обеспечить лучшую воспроизводимость величины поверхности капли, устранить втягивание ртути в капилляр при свободном отрыве и всасывание раствора в капилляр.
Наиболее совершенной современной конструкцией ртутного капающего электрода с принудительным отрывом капли является статический ртутный электрод. Специальное устройство позволяет формировать каплю ртути с любым периодом жизни и любого размера в пределах, зависящих от внутреннего диаметра капилляра.
Перед регистрацией полярограммы необходимо удалить растворенный кислород, поскольку он электроактивен. Сделать это можно, насыщая раствор интертным газом (азот, аргон, гелий). В рутинных работах из щелочных растворов кислород иногда удаляют с помощью сульфита натрия (О2 + 2Na2SO3 ® 2Na2SО4).
Классическую полярограмму характеризуют три параметра: сила тока I, мкА (или пропорциональная величина – высота волны, мм), потенциал в точке максимального наклона E 1/2, В, называемый потенциалом полуволны, и наклон, мВ. Они и позволяют использовать полярографию как метод анализа (сила тока пропорциональна концентрации) и исследования (E 1/2 и наклон зависят от природы вещества).
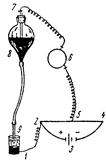
| Рис. 15.4. Схема для электролиза с капельно-ртутным катодом: 1 – анод; 2 – положительный полюс потенциометра; 3 – аккумулятор; 4 – отрицательный полюс потенциометра; 5 – подвижный контакт; 6 – зеркальный гальванометр; 7 – платиновый контакт; 8 – резервуар с ртутью; 9 – капилляр. |
Схема простейшей визуальной установки для электролиза с ртутным капающим электродом изображена на рис. 15.4. Анод электролизера 1 соединен при помощи платинового контакта и проволоки возможно малого сопротивления с одним концом потенциометра 2, который присоединен к положительному полюсу аккумулятора 3. Отрицательный полюс аккумулятора соединен с другим концом потенциометра 4. При помощи подвижного контакта 5 напряжение, подаваемое от аккумулятора, ответвляется через зеркальный гальванометр 6 к платиновому контакту 7, вставленному в резервуар с ртутью 8. Резервуар соединен толстостенной резиновой трубкой с капилляром 9, из которого вытекают капли ртути и, которые до их обрыва от капилляра являются катодом.
В качестве анода применяют большой слой ртути 1, налитый в электролизер, или неполяризующийся насыщенный каломельный электрод. Последний является наиболее распространенным стандартным электродом сравнения, представляющим собой металлическую ртуть в контакте с ионами Hg22+ в растворе КСl. Источником ионов Hg22+ является Hg2Cl2 – каломель.
В начале процесса электролиза, при небольших значениях приложенного напряжения, сила тока, проходящего через раствор, почти постоянна и лишь очень медленно возрастает. Это так называемый остаточный ток. При наличии в растворе веществ, способных восстанавливаться или окисляться, в момент достижения для каждого из них характерного потенциала, сила тока резко возрастает и после достижения определенной величины остается постоянной и независимой от приложенного напряжения. Устанавливается так называемый предельный ток диффузии, который пропорционален концентрации анализируемого вещества.
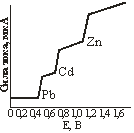 Рис. 15.5. Полярограмма смеси ионов.
Рис. 15.5. Полярограмма смеси ионов.
При одновременном присутствии в растворе нескольких ионов с различными потенциалами восстановления или окисления на полярограмме получается несколько волн, соответствующих моменту разряжения каждого из них. При этом кривая имеет многоступенчатый вид (рис. 15.5). Местоположение каждой ступени волны, отвечающее потенциалу выделения того или иного иона или молекулы, характеризует качественный состав раствора; высота полярографической волны адекватна концентрации вещества в растворе.
Вольтамперометрия. Среди методов и средств, которыми располагает современная аналитическая химия, электрохимические мсюды анализа (вольтамперометрия, потенциометрия, кулонометрия и др.), или электроанализ, по частоте применения в решении проблем окружающей среды занимают одно из первых мест. Особенность этой группы методов состоит в том, что аналитический сигнал возникает за счет протекания процессов, связанных с переносом электрических зарядов и определяется одним или несколькими параметрами: равновесным или неравновесным электродным потенциалом, потенциалом разложения (восстановления или окисления), током собственно электролиза, емкостью двойного электрического слоя и т.д.
Спектр применения методов электроаналитической химии достаточно широк, а в некоторых случаях они конкурируют с такими методами, как ВЭЖХ и ААС. Из методов вольтамперометрии в большей мере требованиям мониторинга экотоксикантов по пределам обнаружения и диапазону определяемых концентраций отвечает инверсионная вольтамперометрия (ИВА). Анализ литературы показывает, что с помощью ИВА можно определять содержания токсичных металлов и металлорганических соединений в природных объектах на уровне ПДК и ниже. Для этого определяемое вещество при соответствующем потенциале выделяют электрохимически на поверхности индикаторного электрода (ртуть, графит, стеклоуглерод и др.) и подвергают полученный концентрат электролитическому растворению. Поскольку содержание определяемого компонента в концентрате на несколько порядков выше, чем в растворе, то аналитический сигнал также возрастает. ИВА позволяет регистрировать аналитический сигнал при концентрациях ионов токсичных металлов (Cu2+, Cd2+, Pb2+, Zn2+ на уровне ~10 нг/л. Следует заметить, что предварительное концентрирование определяемых веществ на поверхности электрода может протекать по-разному: электрохимически и неэлектрохимически. Если первый путь, как было показано выше, состоит в предварительном электролизе следовых количеств ионов металлов в анализируемом растворе на стационарном микроэлектроде с последующим анодным растворением образующегося осадка, то второй – с концентрированием определяемых веществ на поверхности индикаторного электрода за счет адсорбции с последующим восстановлением или окислением. Поскольку возможности ИВА подробно рассмотрены в ряде обзоров и монографий, ниже изложены лишь особенности ее применения в анализе объектов окружающей среды.
Преимуществом вольтамперометрии применительно к анализу природных объектов является то, что она позволяет наряду с определением концентрации идентифицировать и форму нахождения ионов в воде Токсичность природных вод в большей степени определяется физико-химическими свойствами и формой нахождения элементов в них. Цель исследования состоит в определении содержания различных форм металлов, которые и составляют в сумме общую концентрарацию. Обычно наибольшую токсичность имеют гидратированные ионы к их лабильные комплексы, диссоциация которых протекает относительно легко. Наименее токсичными являются устойчивые комплексы металлов и ионы, адсорбированные на коллоидных частицах. Высокой токсичностью обладают и комплексы металлов с липофильными лигандами. поскольку они способны проникать в организм через клеточные мембраны. К этой группе oiносят прежде всего металлорганические coединения алкилированные производные свинца (например, тетраэтилсвинец), ртути, олова и т.д. Различную токсичность металлов в зависимости от формы существования элемента можно проиллюстрировать на примере свинца. Так, величина D50, найденная в опытах на крысах, составляет для Et4Pb 12-14 мг/кг, для Et4PbCl – 20 мг/кг, для Et2PbCl2 – 120 мг/кг и для Pb2+ – 810 мг/кг. Заметим, что с помощью ИВА при варьировании потенциала электронакопления возможно определение в одном растворе днметил-, триметил- и так называемого неорганического свинца. При потенциале -1,4 В все соединения свинца подвергаются электролизу и концентрируются в объеме ртутного электрода. “Неорганический” свинец и диметилсвинец накапливаются при -0,6 В. В присутствии комплексона III ионы свинца образуют прочные комплексы, которые при потенциале -0,6 В уже не могут восстанавливаться на электроде, так что концентрированию подвергается только диметилсвинец. Последний и определяют по анодному пику его растворения.
Инверсионную вольтамперометрию можно использовать также для определения неорганических токсикантов в крови. Однако следует учитывать, что белковые компоненты крови являются поверхностно-активными веществами, адсорбция которых на электроде может сделать невозможным проведение анализа. Для преодоления данного препятствия применяют специальные электроды: импрегнированный графитовый и в виде тонкой пленки графита. Указанные электроды, особенно пленочный графитовый, позволяют определять свинец и кадмий в крови даже без специальной подготовки пробы.
Таким образом, хотя инверсионная вольтамперометрия и требует в ряде случаев специальной пробоподготовки для устранения мешающего влияния поверхностно-активных веществ, растворенных гуминовых и фульвокислот, связывающих ионы металлов в прочные комплексы, она с успехом может применяться для определения содержания токсичных металлов в природных средах, прежде всего в поверхностных водах, снеге, донных отложениях и т.д. ИВА является в настоящее время одним из методов, которые позволяют успешно решать сложные проблемы оценки загрязнения окружающей среды экотоксикантами.
Методы вольтамперометрии применимы для определения и других высокотоксичных органических соединений. Установлено, что на поверхности электрода из пирографита за счет структурного подобия гексагонов графита и молекул ПАУ возможна адсорбция последних. Это приводит к их накоплению и позволяет вольтамперометрически определять полиароматические углеводороды, в частности бенз(а)пирен, в воде, почве и воздухе на уровне предельно допустимых концентраций.
Помимо разнообразных методов инструментального анализа для определения экотоксикантов применяют также микро- и ультрамикрометоды обнаружения, основанные на ферментативных и иммунохимических реакциях. Как оказалось, эти реакции имеют ряд достоинств, что вызывает повышенный интерес к ним при организации эколого-аналитического мониторинга. Основная сфера применения ферментативных и иммунохимических методов ограничивается веществами, угнетающими ферментные системы и вызывающими в живом организме образование антител. Как было показано выше, именно к ним относится большинство экотоксикантов. Предел обнаружения ферментативных и иммунохимических методов очень низок; в отдельных случаях удается определять исследуемые соединения на уровне 10–6 моль и ниже. Внимания заслуживает и тот факт, что механизм получения информации о составе анализируемых объектов в этом случае аналогичен природным процессам.
Биосенсор – это устройство, в котором чувствительный слой, содержащий биологический материал (ферменты, ткани растений и животных, бактерии, дрожжи, антигены, антитела, липосомы, рецепторы, ДНК и др.), непосредственно реагирует на присутствие определяемого компонента, генерируя аналитический сигнал. Конструктивно биосенсоры состоят из двух трансдьюсеров (преобразователей) – биохимического и физического, находящихся в тесном контакте друг с другом. На рис. 15.6 приведена общая схема такого устройства. Биохимический преобразователь, или биотрансдьюсер, выполняет функцию биологического элемента распознавания определяемого компонента, преобразуя информацию о нем в аналитический сигнал, а физический преобразователь фиксирует его аппаратурно. В настоящее время наиболее широко используются биосенсоры с электрохимическими преобразователями. Одни из них представляют собой специальный электрод, на который нанесен слой биоматериала, а другие регистрируют ток электрохимической реакции одного из участников ферментативного процесса на поверхности электрода. Первые относятся к потенциометрическим сенсорам, а вторые – к амперометрическим. Функционально биосенсоры сопоставимы с биорецепторами, которые преобразуют реакцию живых организмов на воздействие окружающей среды в электрические сигналы.
Следует заметить, что большинство биосенсоров разработаны для контроля за содержанием биологически активных веществ и лекарственных препаратов in vivo. С аналитической точки зрения биосенсоры можно разделить на две группы.
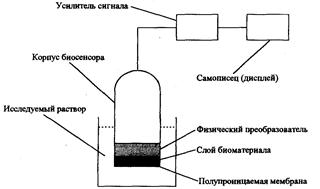
Рис. 15.6. Принципиальная схема биохимического сенсора
К первой группе относятся потенциометрические устройства с иоио-селективными электродами в качестве электрохимического преобразователя. Полагают, что в техническом плане они наиболее просты. Аналитический сигнал регистрируют с помощью обычных потенциометров (рН-метров). Время отклика таких сенсоров зависит в основном от времени установления электрохимического равновесия на границе поверхность электрода/мембрана/раствор и составляет обычно от 2 до 10 мин. Указанные сенсоры можно рассматривать как усовершенствованные устройства по определению концентрации кислоты, образующейся в ходе ферментативной реакции при добавлении к раствору фермента.
Вторая группа холинэстеразных биосенсоров представляет собой амперометрические датчики. Индикаторной реакцией, генерирующей аналитический сигнал, является электрохимическое окисление или восстановление продуктов ферментативного гидролиза на поверхности электрода. Данные биосенсоры отличаются быстродействием (время измерения 12-15 с) и более высокой чувствительностью по сравнению с потенциометрическими устройствами. При этом обеспечивается постоянство отклика в широком диапазоне концентраций определяемых компонентов.
рН-Электрод с иммобилизованной холинэстеразой применяется в системах автоматического контроля качества речной воды во Франции. Датчик позволяет определять 3×10–7% этилпараоксона, 5×10–7% метилпараоксона, 4×10–7 % малатиона, 1,4×10–6% этилпаратиона и метилпаратиона. Предусмотрена реактивация фермента обработкой растворами оксимов. Во всех случаях указанный электрод определяет токсичное действие примесей, содержащихся в воде (антихолинэстеразная токсичность). Установлено, что этот показатель коррелирует с токсичностью, определяемой методами биотестирования.
Амперометрические биосенсоры на основе иммобилизованной холинэстеразы представляют собой устройства, позволяющие определять токсичные вещества на более низком уровне, чем в случае потенциометрических датчиков. Можно выделить два принципиальных подхода к конструированию амперометрических биосенсоров: использование синтетических субстратов, образующих при гидролизе легко окисляющиеся продукты (эфиры тиохолина, индоксилацетат и др.), и разработка биферментных датчиков. В первом случае генерируемый ток пропорционален концентрации продукта реакции, содержание которого в растворе зависит от активности фермента. В датчиках другого типа для формирования отклика используют два фермента: холинэстеразу и холиноксидазу. Последний фермент участвует в каталитическом цикле, связанном с переносом электронов. Селективность определений в случае амперометрических датчиков зависит также от потенциала электрода, обеспечивающего протекание электрохимической реакции.
Обычно такие измерения проводят со стационарным ртутным электродом с серебряной подложкой, представляющим собой серебряную проволоку, впаянную в стекло. Иммобилизованная в пленку из нитроцеллюлозы холинэстераза располагается параллельно корпусу электрода. Как оказалось, данный биосенсор позволяет определять содержание тяжелых металлов в диапазоне концентраций: Hg2+ – 10–5-10–12, Pb2+-10–7-10–9, Cd2+ – 10–7-10–9 моль/л. Разработана также методика определения пестицида 2,4-Д в молоке с пределом обнаружения до 10–12 моль/л. Интерес представляет сравнение основных характеристик методов определения фосфорорганических пестицидов, из которого можно сделать вывод о высокой эффективности применения биосенсоров на основе иммобилизованной холинэстеразы.
Радиоизотопный анализ. Для контроля за содержанием радионуклидов в природных объектах в основном находят применение методы радиохимии и g-спеетрометрии, реже – a- и b-спектрометрии. Данные показывают, что допустимые содержания отдельных радионуклидов (напр., 210Ро, 239Рu ) в воде и атмосферном воздухе составляют 10–14-10–11 мг/л. Очевидно, что определение таких концентраций загрязняющих веществ невозможно без их предварительного концентрирования. Очень важно также оценить погрешность измерений, иначе неоправданно возрастает сложность методик анализа. Сказанное выше относится и к контролю общего радиоактивного загрязнения окружающей среды, который является подсистемой Единой государственной системы экологического мониторинга.
Усиление контроля за радиоактивным загрязнением биосферы требует постоянного повышения чувствительности и разрешающей способности методов радиоизотопного анализа, а также надежной идентификации радионуклидов. Известно, что качественный состав радионуклидов, встречающихся в природных объектах, не отличается постоянством и зависит от множества факторов, которые не всегда известны исследователю. Основную опасность для окружающей среды представляют следующие нуклиды: 24Na,45Са, 46Sc, 54Мn, 56Мn, 59Fе,57Со, 58Со, 60Co, 90Sr, 137Cs, 152Eu, 154Eu, 234Th, 237U, 239Np. Поэтому при подготовке проб к анализу существенное значение имеют тип исходного материала, его происхождение и свойства, позволяющие высказать предположения о наличии тех или иных радионуклидов. В большинстве случаев предварительная подготовка проб к анализу заканчивается озолением исследуемого материала при 400-500°С до полного удаления органических веществ (при определении радиоизотопов иода пробу не подвергают озолению).
Для концентрирования и разделения радионуклидов применяют дистилляцию, экстракцию, ионообменную хроматографию, электродиализ, осаждение, соосаждение и др. Методы ионного обмена и электродиализа используют, как правило, при концентрировании нуклидов из слабоминерализованных вод (снеговая, дождевая и т.п.). Для концентрирования нуклидов из водных проб с более высоким содержанием солей применяют методы осаждения и соосаждения. Выбор метода концентрирования зависит также от активности пробы. Так, при концентрировании радионуклидов из природных вод необходимо отбирать пробу объемом 50-200 л. В этом случае используют ионообменную хроматографию, поскольку метод выпаривания неприменим. Концентрирование достигается пропусканием пробы через колонку с катионитом или с катионитом и анионитом, а также перемешиванием воды с ионообменными смолами. Сорбированные на катионите или анионите нуклиды извлекают озолением смолы при 500°С, десорбцией кислотами или комплексообразующими реагентами. Применение элюентов, содержащих комплексообразователи, позволяет достичь тонкого разделения элементов с весьма близкими химическими свойствами.
Следует заметить, что в природных водах определяют главным образом содержание 90Sr и 137Cs. Их концентрирование сводится в основном к осаждению в виде труднорастворимых солей. Так, при выделении 90Sr широко применяют осаждение карбонатов после введения носителя или соосаждение Sr с Са, присутствующим в воде, добавлением кристаллической соды. Воду предварительно подкисляют НСl или HNO3 для разрушения бикарбонатов, а затем доводят рН до 7 с помощью NH4OH и осаждают карбонаты. Цезий осаждают с ферроцианидами тяжелых металлов (Fe, Zn, Co). При выделении радионуклидов они осаждаются на носителе за счет сокристаллизации или адсорбции..
Наиболее широко в настоящее время применяется нейтронно-актива-ционный анализ, в основе которого лежит поглощение ядрами элементов тепловых нейтронов. В результате этой реакции образуются изотопы, большей частью радиоактивные. Подавляющее большинство из них являются g-излучателями, по площадям пиков g-спектров которых можно рассчитать их содержание в пробе. Для этого активность элемента в образце сравнивают с активностью стандартного образца определяемого элемента, содержание которого известно.
В качестве источников нейтронов используют ядерные реакторы, нейтронные генераторы, радиоизотопы и др. Наибольшую мощность потока нейтронов получают в ядерных реакторах в процессе управляемой цепной реакции деления. Одновременно в реакторе можно облучать 30-40 образцов массой до нескольких граммов. В практике серийных анализов природных объектов нейтронные генераторы широкого распространения не получили.
Пробы и стандартные образцы, подготовленные к облучению, помещают в цилиндрические алюминиевые или полиэтиленовые контейнеры диаметром 15-20 мм и длиной 150-200мм. Продолжительность облучения зависит от состава определяемых элементов и периода полураспада образующихся нуклидов. Для повышения чувствительности обычно используют относительно короткоживущие изотопы. Так, определение ртути проводят по 197Hg (T1/2 = 64,1 ч), а не по 203Hg (T1/2 = 46,6 сут.). Для природных вод оптимальное время выдержки проб в реакторе составляет 10-50 сут. При этом возможно определение элементов в пробах воды на уровне следующих концентраций:
10–1-10–2 мг/л – Fe, Sr, Sn, Ba;
10–3-10–4 мг/л – Сr, Со,Zn, Sb, Cs, Hg;
10–5-10–6 мг/л – Sc, Au.
Следует заметить, что нижняя граница определяемых концентрации для конкретного элемента зависит также от уровня мешающих излучений, общей активности пробы, ее нуклидного состава и может изменяться на порядки.
Литература
1. Корте Ф. Экологическая химия. – М.: Мир, 1997. – 395 с.
2. Химия окружающей среды // Под ред. Дж. М. Бокриса. – М.: Химия, 1982. – 672 с.
3. Будников Г.К., Майстренко В.Н., Хамитов Р.З. Эколого-аналитический мониторинг супертоксикантов. – М.: Химия, 1996. – 319 с.
4. Никольская А.Н., Федорова А.И. Практикум по экологии и охране окружающей среды. – М.: ВЛАДОС, 2001. – 286 с.
5. Другов Ю.С. Экологическая аналитическая химия. – М.: 2000. – 432 с.
6. Фелленберг Г. Загрязнение природной среды. – М.: Мир, 1997. – 232 с.
7. Орлов Д.С. Экология и охрана биосферы при химическом загрязнении. – М.: Высшая школа, 2002. – 334 с.
8. Воробьев О.Г. Инженерная защита окружающей среды. – С-Пб.: Лань, 2002. – 287 с.
9. Медведев В.Т. Инженерная экология. – М.: Гардарики, 2002. – 687 с.
10. Исидоров В.А. Введение в химическую экотоксикологию. – С-Пб.: Химиздат, 1999. – 140 с.
11. Исидоров В.А. Экологическая химия. – С-Пб.: Химиздат, 2001. – 304 с.
12. Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основы современного электрохимического анализа. – М.: «Мир», 2003. – 592 с.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1846; Нарушение авторских прав?; Мы поможем в написании вашей работы!