
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель рН
|
|
|
|
Диссоциация воды
Роль воды в организме
Растворимость веществ
Образование любых химических связей энергетически выгодно. Поэтому, чем больше водородных связей и электростатических взаимодействий между водой и веществом, тем энергетически выгоднее процесс растворения (ΔНраств< 0).
1. Большинство процессов в организме происходят в водной среде. Она - основной компонент внутри- и внеклеточной среды.
2. Вода растворяет все соединения, участвующие в обмене веществ.
3. Участвует в формировании пространственной структуры белков, ДНК, РНК и надмолекулярных комплексов (клеточные мембраны).
4. Играет важную роль в транспорте веществ между органами и органеллами клетки и выведении продуктов обмена из организма.
5. Текучесть воды определяет скорость транспорта веществ и выведения продуктов обмена из организма.
6. Теплоемкость воды определяет температурную адаптацию организма.
7. Электропроводность водных растворов влияет на электрофизиологические свойства клеток (проводимость нервных сигналов).
2/3 воды в организме –внутриклеточная жидкость, т.е. вода структурирована.
Вода - слабый электролит и лишь в очень небольшой степени диссоциирует на ионы: Н2О ↔ Н+ + ОН-
Кдис. воды - это константа равновесия процесса диссоциации воды
Кр = Кдис. воды = [H+][OH-]/[H2O] = 1,821*10-16
[H2O] = Const = m/M = 1000 г/18 г/моль = 55,35 моль/л.
[H+][OH-]= Кдис. воды*[H2O] = 55,35*1,821*10-16 = 10-14
[H+][OH-] называется ионным произведением воды и обозначается Кw
Кw = [H+][OH-] = 10-14
Если среда нейтральная, то [H+] = [OH-] = √10-14 = 10-7
Десятичный логарифм молярной концентрации ионов водорода, взятый с обратным знаком, называют водородным показателем рН.
рН = – lg [H+]
Гидроксильный показатель рОН = – lg [ОH-].
Прологарифмируем выражение для ионного произведения воды [H+][OH-] = 10-14 и возьмем его с обратным знаком: – lg[H+] – lg[OH-] = 14
или рН + рОН = 14
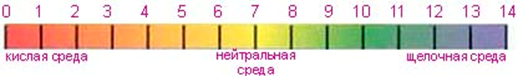
Шкала рН:
Закон Оствальда ( закон разбавления для слабых электролитов )
Процесс электролитической диссоциации, как и в случае воды, может быть охарактеризован константой диссоциации (Кдис.).
Так, для кислоты НА ↔ Н++А- константа диссоциации имеет вид:
Кдис. НА= [Н+][А-]/[НА]
Закон Оствальда отражает взаимосвязь между константой диссоциации и степенью диссоциации бинарного (распадающегося на два иона) слабого электролита, например, слабой кислоты НА.
[Н+] = [А-] = αС, [НА] = (1- α)С
α – степень диссоциации слабой кислоты,
С – исходная концентрация кислоты.
Тогда: К дис. НА= [H+] [A-] / [HA] = αС·αС/(1- α)С
Кдис НА = α2С/(1-α)
Если α<<1, то (1-α) ~1, следовательно Кдис НА = α2С,
 отсюда: α = √ Кдис/См
отсюда: α = √ Кдис/См
Как видно из этого уравнения, с ростом концентрации степень диссоциации падает и, наоборот, с разбавлением электролита α растет.
ЛЕКЦИЯ № 3
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!