
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные электроды и цепи
|
|
|
|
На электродах всех гальванических элементов происходят реакции окисления или восстановления. Название же окислительно-восстановительных электродов применяется в более узком смысле.
Окислительно-восстановительными (или редокс) называются такие электроды или цепи, в которых материал электрода не изменяется, а лишь служит источником или приемником электронов, получаемых или отдаваемых веществами, восстанавливающимися или окисляющимися на поверхности электродов. Простым примером такого электрода может служить пластинка из платины, опущенная в раствор, содержащий хлорное железо FeCl3 и хлористое железо FeCl2. При сочетании такого электрода с каким-либо другим образуется гальванический элемент, в котором в зависимости от вида другого электрода происходит или окисление Fe2+ в Fe3+, или восстановление Fe3+ в Fe2+.
Если другой электрод в элементе является положительным по отношению к окислительно-восстановительному, то реакция Fe2+ D Fe3+ будет проходить вправо (окисление),если же он является отрицательным, то реакция будет происходить влево (восстановление).
В сущности, отличием такого электрода от электродов, рассмотренных ранее, является то, что здесь продукты и окисления и восстановления остаются в растворе, а не выделяются на электроде. Потенциал такого электрода может быть определен по формуле
j Fe2+/Fe3+ = j0Fe2+/Fe3+ + 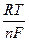
 ln
ln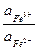 .
.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2371; Нарушение авторских прав?; Мы поможем в написании вашей работы!