
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активного комплекса или переходного состояния
|
|
|
|
Теория активного комплекса основана на том, что элементарный акт взаимодействия молекул состоит в постепенной перестройке химических связей, при которой начальная конфигурация атомов у исходных молекул переходит в конечную у продуктов реакции при непрерывном изменении межатомных расстояний.
Например, при сближении двух двухатомных молекул между ними образуется сначала некоторое неустойчивое соединение—переходное состояние или активный комплекс—из четырех атомов, который после перераспределения энергии по химическим связям распадается на две новые молекулы. Таким образом, механизм элементарной реакции
AB + CD ® AC + BD,
согласно теории активного комплекса можно, представить следующим образом:
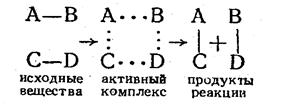 .
.
Активный комплекс не является молекулой или промежуточным соединением, так как реагирующие молекулы в переходном состоянии обладают максимальной энергией.
Теорию активного комплекса предложили в 1935 г. Эйринг и одновременно Эванс и Поляни. Применение статистической термодинамики позволило им создать принципиальный метод теоретического вычисления абсолютных скоростей химических реакций.
Рассмотрим механизм реакции
А + ВС ® АВ + С,
согласно теории активного комплекса. При сближении атома А с молекулой ВС ослабляется связь В—С и возникает связь А—В.
Процесс завершается образованием молекулы АВ и атома С, для чего система должна пройти через активный комплекс ABC*, когда атом В в одинаковой степени принадлежит прежней молекуле ВС и новой молекуле АВ:
А + ВС ®АВС *-®АВ + С.
В течение реакции изменяются расстояния между А—В и В—С и, соответственно этому, изменяется потенциальная энергия системы. Указанные изменения могут быть представлены трехмерной диаграммой, на двух координатных осях которой наносят расстояния А—В и В—С между атомами, а отвечающую им энергию Е откладывают на третьей координате. Для более сложных случаев требуется многомерная диаграмма. Трехмерную диаграмму можно заменить плоской, если на горизонтальную плоскость, ограниченную координатами А—В и В—С, нанести линии равной энергии, которые представляют собой проекции сечения энергетической кривой плоскостями, перпендикулярными к оси энергии. Такое построение называется энергетической картой.

Потенциальная поверхность реакции представлена на энергетической карте. Цифры около горизонталей обозначают энергию, которой обладают системы A+BC и AB+C в зависимости от расстояния А—В или В—С. На энергетической карте можно выделить долину Р1, в которой система А+ВС находилась до реакции, и долину Р2, в которой находится система AB+С, возникшая в результате реакции. Для перехода от Р1 к Р2 система должна преодолеть энергетический барьер, разделяющий обе долины. Для такого перехода существует наиболее выгодный энергетический путь, проходящий по ложбине через самую низкую точку Р перевала. Перевальная точка Р и соседние с ней участки отвечают области существования активного комплекса, который отличается от стабильных молекул своей неустойчивостью вдоль пути реакции, изображенной на карте пунктирной линией. По отношению к изменениям в других направлениях активный комплекс устойчив, так как эти изменения энергетически невыгодны. Активный комплекс как бы катится в ложбине вдоль пути реакции, тогда как стабильные молекулы находятся в долинах
Разность между потенциальной энергией Р1 исходных веществ и потенциальной энергией активного комплекса в перевальной точке Р равна энергии активации, обладая которой, молекулы исходных веществ в состоянии преодолеть потенциальный барьер и перейти в конечные продукты реакции. Если сделать разрез потенциальной поверхности, перпендикулярный к плоскости чертежа и проходящий вдоль пути реакции, а затем развернуть поверхность разреза в одну плоскость, то получим кривую, представляющую собой профиль пути реакции.

Теория активного комплекса позволяет рассчитать скорость реакции, если известны свойства активного комплекса (переходного состояния). Обозначим d некоторый интервал вдоль пути реакции, включающий вершину Р потенциального барьера. Существующая в этом интервале конфигурация атомов, движущихся на энергетической диаграмме в сторону конечных продуктов, называется активным комплексом, или переходным состоянием. Система проходит участок d за некоторое время t, называемое средним временем жизни активного комплекса.
Прохождение системы через переходное состояние можно рассматривать как поступательное ее движение вдоль пути реакции. Среднее время жизни активных комплексов
t = 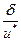 ,
,
где u* — средняя скорость прохождения активными комплексами вершины потенциального барьера Р.
Обозначим через сак концентрацию активных комплексов в интервале d на координате реакции. Она равна числу возникающих активных комплексов или числу элементарных актов реакции за время t. Скорость реакции, равная числу актов реакции в единице объема за единицу времени, определяется уравнением
J = 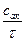 =
=  ,
,
которое справедливо тогда, когда возникшие активные комплексы полностью превращаются в конечные продукты реакции.
В более общем случае в уравнение нужно ввести добавочный множитель c, называемый трансмиссионным коэффициентом, или коэффициентом прохождения. Он учитывает долю c активных комплексов, скатывающихся с перевала Р в долину Р2 и распадающихся при этом на конечные продукты реакции; а доля 1 — c активных комплексов скатывается обратно в долину Р1, распадаясь на исходные вещества.
Таким образом,
J = c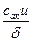 .
.
На основе теории активного комплекса рассчитаем константу скорости бимолекулярной реакции:
А + В ® АВ* ® АВ.
Скорость односторонней элементарной реакции выражается уравнением
J = kcAcB,
где k — константа скорости реакции. Приравнивая правые части уравнений, получим
k = c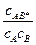
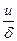 .
.
В теории активного комплекса делается допущение, что активный комплекс находится в статистическом равновесии с исходными реагирующими веществами.
Поэтому уравнение можно представить в виде
k = cK¹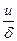 ,
,
где K¹ —константа равновесия:
K¹ = 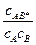 .
.
Эту константу равновесия можно рассчитать, используя методы статистической термодинамики.
В результате расчетов получается уравнение
k = c K¹,
K¹,
где К¹ - обычная термодинамическая константа равновесия
Это уравнение связывает константу скорости реакции с константой равновесия между исходными веществами и активным комплексом и позволяет использовать математический аппарат химической термодинамики для расчетов в химической кинетике. Фактически такие расчеты во многих случаях не удается провести из-за недостаточных сведений о строении активного комплекса.
В соответствии с общим термодинамическим уравнением для равновесия между активным комплексом и исходными веществами можно написать
DG* = -RTlnK¹ = DH* - TDS*;
или
K¹ = e-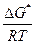 = e
= e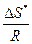 e-
e- ;
;
k = c e-
e-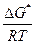 = c
= c e
e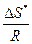 e-
e- ,
,
где DG* — изобарный потенциал активации; DS* — энтропия активации; DH* — энтальпия активации.
Из уравнения можно рассчитать константу скорости реакции, зная энтропию и энтальпию активации.
Чтобы выяснить физический смысл энтальпии активации DH*, прологарифмируем уравнение
lnk = lnc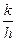 + lnT + lnK¹;
+ lnT + lnK¹;
и возьмем от него производную по температуре:
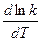 =
= 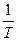 +
+  ;
;
нам известно
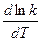 =
= 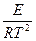 ;
;
 =
=  ,
,
отсюда
E = DH* + RT.
Для многих реакций значение энергии активации значительно больше RT
(E» 50—200 кДж/моль; при 25° RT=2,5 кДж/моль). Поэтому величиной RT в уравнении можно пренебречь и заменить DH* энергией активации, определенной из уравнения Аррениуса.
Теория активного комплекса позволяет вычислить стерический фактор Р.
k = PZ0e-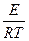 ;
;
k = c e
e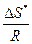 e-
e- ;
;
P = c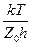 e
e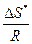 .
.
Стерический фактор называют также энтропийным множителем, или вероятностным фактором. Энтропия активации может быть вычислена при помощи статистической термодинамики, если известно строение активного комплекса. В настоящее время такие расчеты могут быть выполнены только для простейших реакций, так как в большинстве случаев строение активного комплекса неизвестно.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2763; Нарушение авторских прав?; Мы поможем в написании вашей работы!