
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности изменения свойств оксидов
|
|
|
|
Классификация оксидов по химическим свойствам
Классификация оксидов и закономерности изменения химических свойств
По химическим свойствам оксиды разделяются на следующие типы:
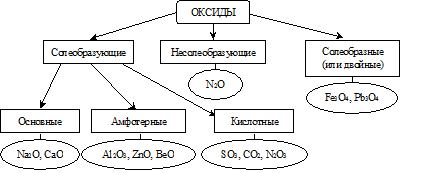
Несолеобразующими называются оксиды, которым не соответствуют ни кислоты, ни основания.
Солеобразными оксидами называются двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4, Fe3O4, Mn3O4 (формулы этих оксидов могут быть записаны также в виде 2 PbO × PbO2; FeO × Fe2O3; MnO × Mn2O3 соответственно).
Например, Fe3O4 Þ FeO × Fe2O3: представляет собой основный оксид FeO химически связанный с амфотерным оксидом Fe2O3, который в данном случае проявляет свойства кислотного оксида. И Fe3O4 формально можно рассматривать как соль, образованную основанием Fe(OH)2 и кислотой [HFeO2 ], которая не существует в природе:
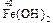 + 2 [
+ 2 [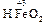 ] =
] =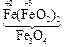 + H2O.
+ H2O.
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH)2, как основания, могут быть получены два двойных оксида — Pb2O3 и Pb3O4 (сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй — ортосвинцовой кислоты (H4PbO4).
Cреди оксидов, особенно среди оксидов d-элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана (II) TiO изменяется в пределах TiO0,65 – TiO1,25.
Солеобразующими оксидами называются оксиды, которые образуют соли. Оксиды этого типа делятся на три класса: основные, амфотерные и кислотные.
Основными оксидами называются оксиды, элемент которых при образовании соли или основания становится катионом.
Кислотными оксидами называются оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
Амфотерными оксидами называются оксиды, которые в зависимости от условий реакции могут проявлять как свойства кислотных, так и свойства основных оксидов.
При образовании солей степени окисления элементов, образующих оксиды, не изменяются, например:
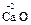 +
+ =
=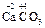 .
.
Если при образовании соли происходит изменение степеней окисления элементов, образующих оксиды, то получившуюся соль следует отнести к соли другой кислоты или другого основания, например,
а) 2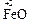 + 4
+ 4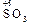
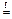
 +
+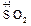 .
.
Fe2(SO4)3 представляет собой соль образованную серной кислотой и гидроксидом железа (III) — Fe(OH)3, которому соответствует оксид Fe2O3.
б) 2 KOH + 2 =
=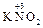 +
+ + H2O.
+ H2O.
Образовавшиеся соли являются солями азотистой ( ) и азотной (
) и азотной ( ) кислот, которым соответствуют оксиды
) кислот, которым соответствуют оксиды
 и
и  .
.
Увеличение степени окисления элемента и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на атоме кислорода – dО) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
а) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.
| Na2O основный оксид, сильное основание | MgO основный оксид, слабое основание | Al2O3 амфотерный оксид, амфотерный гидроксид | SiO2 кислотный оксид, очень слабая кислота | P4O10 кислотный оксид, кислота средней силы | SO3 кислотный оксид, сильная кислота | Cl2O7 кислотный оксид, очень сильная кислота |
Таблица 2
Зависимость кислотно-основных свойств оксидов
от эффективного заряда на атоме кислорода
| Оксид | Na2O | MgO | Al2O3 | SiO2 | P4O1023 | SO3 | Cl2O7 |
| Эффективный заряд, dO | – 0,81 | – 0,42 | – 0,31 | – 0,23 | – 0,13 | – 0,06 | – 0,01 |
| Кислотно-основные свойства оксида | Основный | Основный | Амфотерный | Кислотный |
б) В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:
| BeO амфотерный | MgO основный | CaO основный | SrO основный | BaO основный | RaO основный |
 увеличение силы соответствующих оснований увеличение силы соответствующих оснований
|
в) При повышении степени окисления элемента усиливаются кислотные свойства оксида и ослабевают основные:
Таблица 3
Зависимость кислотно-основных свойств
от степени окисления металлов
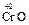 основный оксид основный оксид
|  амфотерный оксид амфотерный оксид
| – |  кислотный оксид кислотный оксид
| – |
 основный оксид основный оксид
|  амфотерный оксид амфотерный оксид
| – | – | – |
 основный оксид основный оксид
|  амфотерный оксид с преобладанием основных свойств амфотерный оксид с преобладанием основных свойств
|  амфотерный оксид с преобладанием кислотных свойств амфотерный оксид с преобладанием кислотных свойств
| 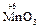 кислотный оксид кислотный оксид
|  кислотный оксид кислотный оксид
|
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1525; Нарушение авторских прав?; Мы поможем в написании вашей работы!