
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение кислот
|
|
|
|
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом
2. Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой.
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:

4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:

Химические свойства кислот можно разделить на две группы: 1) общие для всех кислот реакции, связанные с наличием в их растворах иона Н+ (иона гидроксония НзО+), и 2) специфические, т.е. характерные для конкретных кислот.
Ион водорода может, с одной стороны, вступать в окислительно-восстановительные реакции, восстанавливаясь до водорода, а с другой стороны, вступать в реакции соединения с отрицательно заряженными или нейтральными частицами, имеющими неподеленные пары электронов (кислотно-основное взаимодействие).
К первому типу превращений кислот относятся реакции кислот с металлами, стоящими в ряду напряжений до водорода, например

К кислотно-основному типу относятся реакции с основными оксидами и основаниями, а также со средними, основными, а иногда и кислыми солями:

Заметим, что многоосновные кислоты диссоциируют ступенчато, причем легкость диссоциации по каждой из ступеней падает, поэтому для многоосновных кислот вместо средних солей часто образуются кислые (в случае избытка реагирующей кислоты);
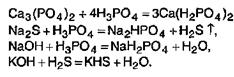
На первый взгляд, совершенно удивительным воспринимается известный факт образования кислых солей одноосновной фтороводородной (плавиковой) кислотой. Однако этот факт объясняется очень просто. В отличие от всех других галогеноводородных кислот, плавиковая кислота в растворах частично полимеризована с образованием молекул (HF)X — H2F2, H3F3 и т.д.
Частным случаем кислотно-основного взаимодействия являются реакции кислот с индикаторами, приводящие к изменению окраски, что издавна используется для качественного обнаружения кислот в растворах.
В качестве индикаторов используют лакмус (в нейтральной среде — фиолетовый, в кислой — красный, в щелочной — синий), метилоранж (в кислой среде — красный, в нейтральной — оранже-
вый, в щелочной — желтый), конго красный (в сильно кислой среде — синий, в нейтральной и щелочной — красный) и многие другие.
Индикаторы обычно представляют собой сложные органические вещества кислого или основного характера, обратимо образующие соли с кислотами и основаниями. Причины изменения окраски индикаторов связаны с изменением строения и вытекающим отсюда изменением светопоглощепия. Для иллюстрации приведем, какие изменения происходят с метилоранжем (солью органической серо- и азотосодержащей кислоты):
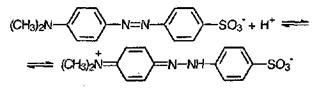
В щелочной среде желтая форма, в кислой среде красная форма, В нейтральной среде смесь равных количеств желтой и красной форм дает оранжевую окраску.
Вторая группа реакций кислот связана со специфическими особенностями различных кислот и подразделяется на два типа: реакции, приводящие к образованию нерастворимых солей, и окислительно-восстановителъныа превращения. Если реакции первой группы, связанные с наличием иона Н+, были общими для всех кислот (качественные реакции для обнаружения кислот вообще), то реакции второй группы могут служить качественными на отдельные кислоты:
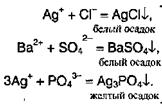
Другой большой подкласс специфических реакций кислот связан с их окислительно-восстановительными возможностями.
Бескислородные кислоты в водном растворе могут только окисляться:

Кислородсодержащие кислоты могут окиспяться только, когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:

Многие кислородсодержащие кислоты, в которых центральный атом имеет максимальную степень окисления (S+, N+, Cr) проявляют свойства сильных окислителей (H2SO4 является сильным окислителем только при высокой концентрации):

|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 735; Нарушение авторских прав?; Мы поможем в написании вашей работы!