
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 4. Классификация и номенклатура
|
|
|
|
Соли
Классификация и номенклатура. Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы –ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: СаСО3•МgСОз (доломит), KCl•NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОС12 (или Ca(OCl)Cl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K4[Fe(CN)6] (желтая кровяная соль), K3[Fe(CN)6] (красная кровяная соль), [NaAl(OH)4], [Аg(NНз)2]С1; гидратные соли, в которых содержатся молекулы кристаллизагщонной воды: CuSO4•5H2O (медный купорос), Na2SO4•10H2O (глауберова соль).
Название солей образуется из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляется суффикс -ид, например хлорид натрия NaCI, сульфид железа (II) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание -am для высших степеней окисления для более низких (для некоторых кислот используется приставка гипо- для низких степеней окисления
неметалла; для солей хлорной и марганцовой кислот используется приставка пер-): карбонат кальция СаСОз, сульфат железа (III) Fe2(SO4)3 сульфит железа (II) FeSО3, гипохлорит калия КОСl, хлорит калия КСlO2, хлорат калия КСlO3, перхлорат калия КОCl4, перманганат калия КМп04, дихромат калия К2Сг2O7.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа ОН — приставкой гидрокси-: NaHS — гидросульфид натрия, NаНSО3 — гидросульфит натрия, Mg(OH)Cl — гидроксихлорид магния, А1(ОН)2С1 — дигидроксохлорид алюминия.
В названиях комплексных ионов сначала указываются лиганды. Название комплексного иона завершается названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используются русские названия металлов, например: [Cu(NH3)4]Cl2 — хлорид тетраамминмеди (II), [Ag(NH3)2]2SО4 — сульфат диамминсеребра (I). В названиях комплексных анионов используются латинские названия металлов с суффиксом -am, например: К[А1(ОН)4] — тетрагцдрок-сиалюминат калия, Nа[Сг(ОН)4] — тетрагидроксихромат натрия, K4[Fe(CN)6] — гексацианоферрат (II) калия.
Названия гидратных солей образуются двумя способами. Можно воспользоваться системой наименования комплексных катионов, описанной выше; например, медный купорос [Cu(H2O)4]SO4•Н2O (или CuSO4•5H2O) в таком случае будет называться сульфат тетраaквa меди (II). Однако для наиболее известных гидратных солей чаще всего степень гидратации указывают численной приставкой к слову «гидрат», например: CuSO4•5H2O — пентагидрат сульфата меди (II), Na2SO4•10H2O — декагидрат сульфата натрия, СаСl2•2Н2O — дигидрат хлорида кальция.
Способы получения и химические свойства. Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей практически обсуждено выше. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов.
Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются:
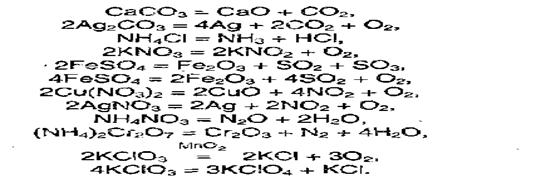
При химических, реакциях солей проявляются особенности как катионов, так v. анионов, входящих в их состав. Ионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений или же в окислительно-восстановительные реакции:
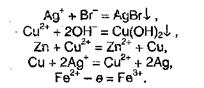
Первые две реакции показывают, что соли могут реагировать с кислотами, солями или основаниями, а последние три указывают на окислительные и восстановительные свойства солей.
С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений, а также участвовать в окислительно-восстановительных реакциях.
Литература:
1. Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
2. Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
- Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
- Зайцев, О.С. Общая химия. Строение веществ и химические реакции / О.С.Зайцев. – М.: Химия, 1990.
- Карапетьянц, М.Х. Строение вещества / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 1981.
- Угай, Я.А. Общая и неорганическая химия / Я.А.Угай. – М.: Высшая школа, 1997.
Тема: ХИМИЧЕСКИЕ РЕАКЦИИ.
Цель: Ознакомить студентов с типами и способами прохождения химических реакций.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 826; Нарушение авторских прав?; Мы поможем в написании вашей работы!