
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процесс диссоциации
|
|
|
|
Процесс распада кристаллов на отдельные ионы протекает следующим образом. Молекулы воды представляют собой диполи. Когда кристалл какой-либо соли (КCl) попадает в воду, то расположенные у поверхности ионы начинает притягивать к себе полярные молекулы воды.

Молекулы воды также притягивают к себе ионы. Так ионы переходят в раствор. Перешедшие в раствор ионы могут оставаться связанными с молекулами воды, тогда они образуют гидраты ионов. Так как размеры катионов меньше размеров анионов, то они сильнее притягивают молекулы воды. Чем меньше радиус катиона, тем меньше молекул воды входит в состав гидратированного иона. Гидраты (сольваты).
Несмотря на образование гидратов, в уравнениях записывают только ионы. Вследствие движения ионов в растворе кроме ионов находятся и недиссоциированные молекулы.
Диссоциации подвергаются не только вещества с ионными кристаллическими решетками, но и многие вещества, состоящие из полярных молекул.
Ионизирующее действие растворителей. Другие растворители – муравьиная кислота, этанол, ацетон; диссоциация происходит, но в меньшей степени. Такие растворители называются ионизирующими. В неполярных или малополярных растворителях (бензол, диэтиловый эфир, сероуглерод) диссоциации не наблюдается. Об ионизирующей способности различных растворителей судят по их диэлектрической проницаемости (диэлектрической постоянной) – это величина, показывающая во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в безвоздушном пространстве.
Чем больше дипольный момент молекул, тем больше диэлектрическая проницаемость.
Степень диссоциации. Скорость распада молекул со временем уменьшается, следовательно увеличивается скорость обратного процесса. В результате устанавливается равновесие, при котором относительные количества недиссоциированных молекул и ионов остаются постоянными.
NaCl ↔ Na+ + Cl-
HCl + H2O ↔ Cl- + H3O+ (в упрощенной форме HCl ↔ H+ + Cl-)
Степень диссоциации – отношение числа диссоциированных молекул к общему числу молекул, перешедших в раствор.
Степень диссоциации зависит от природы растворяемого элемента, от концентрации раствора: при разбавлении раствора степень диссоциации каждого элемента увеличивается (согласно принципу Ле Шателье, в зависимости от осмотического давления).
α = (і – 1 )/ (n – 1)
n – число образовавшихся ионов.
α = 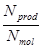 , Nprod – число продиссоциированных ионов; Nmol – общее число молекул.
, Nprod – число продиссоциированных ионов; Nmol – общее число молекул.
На практике степень диссоциации элементов определяют методом, основанным на измерении электропроводности растворов.
6. Константа диссоциации.
Смещение ионного равновесия
Так как электролитическая диссоциация – процесс обратимый, приводящий к состоянию равновесия между недиссоциированными ионами, то она подчиняется закону действия масс.
XY ↔ X+ + Y-
K д = [X+] [Y-] / [XY]
K д характеризует способность электролита дисоциировать на ионы. Чем больше K д, тем сильнее диссоциирует электролит.
K д =α 2 СМ /1 – α закон разбавления Оствальда дает возможность вычислить степень диссоциации при различных концентрациях, если известна константа диссоциации, и наоборот.
Константа диссоциации не зависит от концентрации взятых для реакции реагентов и всегда будет величиной постоянной.
Но для сильных электролитов закон действия масс неприменим. Как же ведут себя сильные электролиты в растворе?
Если в растворе слабых электролитов силами электролитического взаимодействия можно принебречь, то в отношении сильных электролитов этого делать нельзя. Силы межионного притяжения и отталкивания довольно большие, они и являются причиной отклонения растворов сильных электролитов от закона действия масс.
Если опустить в раствор электроды, соединенные с источником электрического тока, то разноименно заряженные ионы начинают перемещаться в противоположные стороны. При этом каждый ион стремится вырваться из своей ионной атмосферы, но покидаемая им атмосфера притягивает его обратно, вследствие чего движение иона замедляется, следовательноснижается число ионов, проходящих через раствор в единицу времени. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы, тем меньше будет электропроводность раствора. Отсюда кажется, что с увеличением концентрации число ионов в растворе снижается, но в действительности диссоциация при любых концентрациях остается полной, поэтому измеряя электропроводность определяют лишь кажущуюся степень диссоциации.
Равновесие в растворах электролитов остается неизменным пока внешние условия не изменяются. Изменение условий влечет смещение равновесия в ту или иную сторону (принцип Ле Шателье).
CaSO4 ↔ Ca2+ + SO4-
Применим закон действия масс:
Кр = [Ca2+][SO4-]
Таким образом в растворе малорастворимого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Так как эта величина характеризует способность электролита растворяться,то её называют произведением растворимости ПР.
ПР (CaSO4)= [Ca2+][SO4-]
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2208; Нарушение авторских прав?; Мы поможем в написании вашей работы!