
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные типы ОВР
|
|
|
|
Окисление и восстановление.
Степень окисления.
Составление уравнений окислительно-восстановительных реакций.
Окислители и восстановители.
Степень окисления. Окисление и восстановление. Основные типы ОВР
Охарактеризовать типы ОВР
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ.
Лекция 9
Тема: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ.
Цель: Ознакомить студентов с понятием степени окисления, рассмотреть протекание ОВР,
Степень окисления элемента в соединении определяется как число электронов, смещенных от атома данного элемента к другим атомам (при положительной степени окисления) или от других атомов к атому данного элемента (при отрицательной степени окисления).
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:
1) степени окисления элемента в простых веществах принимаются равными нулю;
2) алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, равна нулю;
3) постоянную степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы второй группы, цинк и кадмий (+2);
4) водород проявляет степень окисления +1 во всех соединениях кроме гидридов металлов (NaH, CaH2), где его степень окисления равна -1;
5) степень окисления кислорода в соединениях равна -2, за исключением пероксидов (-1) и фторида кислорода ОF2 (+2).
Окислительно-восстановительными называются такие реакции, в результате которых изменяется степень окисления одного или нескольких участвующих в реакции элементов. Отдача атомом электронов, сопровождающаяся повышением его степени окисления, называется окислением; присоединение атомом электронов, приводящее к понижению его степени окисления, называется восстановлением.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем; вещество, содержащее восстанавливающий элемент, называется окислителем. Так, в реакции
4Al +3O2 = 2Al2O3
Al -3ē = Al3+ 3 4 восстановитель
O2 +4ē = 2O2- 4 3 окислитель
Алюминий повышает степень окисления от 0 до +3 и служит восстановителем; в результате реакции восстановленная форма алюминия (свободный алюминий) окисляется и превращается в сопряженную с ней окисленную форму (алюминий в степени окисления +3). Кислород в этой реакции понижает степень окисления от 0 до -2 и служит окислителем; в результате реакции окисленная форма кислорода (свободный кислород) восстанавливается и превращается в сопряженную с ней восстановленную форму (кислород в степени окисления -2). Оба процесса протекают одновременно. При этом общее число электронов, отданных восстановителем, равно общему числу электронов, принятых окислителем.
В рассмотренной реакции взаимодействуют два вещества, одно из которых служит окислителем (кислород), а другое – восстановителем (алюминий). Такие реакции относятся к реакциям межмолекулярного окисления – восстановления.
Реакция
3S + 6KOH = K2SO3 + 2K2S + 3H2O
S + 2ē = S2- 2 2 окислитель
S - 4ē = S4+ 4 1 восстановитель
служит примером реакций самоокисления-самовосстановления (диспропорционирования), в которых функции окислителя и восстановителя выполняет один о тот же элемент. В последней реакции свободная сера (СО=0) выступает одновременно в роли окислителя, восстанавливаясь до СО = -2 (K2S), и в роли восстановителя, окисляясь до СО = +4(K2SO3). Подобные реакции возможны, если соответствующий элемент находится в исходном соединении в промежуточной степени окисления. Так СО свободной серы (0) имеет промежуточное значение между возможными максимальной (+6) и минимальной (-2) степенями окисления этого элемента.
В реакции
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Cr6+ + 3ē = Cr3+ 3 2 окислитель
2N3-- 2*3ē = N2 6 1 восстановитель
восстанавливается хром, понижающий степень окисления от +6 до +3, а окисляется азот, повышающий СО от -3 до 0. Оба эти элемента входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления. К ним относятся, в частности, многие реакции термического разложения сложных веществ.
Независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов. Процесс окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи. Пусть в стакан 2 налит раствор иодида калия (рис.1), а в стакан 4 – раствор хлорида железа (III). Растворы соединены между собой так называемым «электролитическим ключом» 3, U-образной трубкой, заполненной раствором хлорида калия, обеспечивающим ионную проводимость. В растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь, включив в нее чувствительный амперметр, то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление. Электроны перемещаются от электрода с раствором иодида калия к электроду с раствором хлорида железа (III), т. е. от восстановителя – ионов I- – к окислителю – ионам Fe3+. При этом ионы I-окисляются до молекул I2, а ионы Fe3+ восстанавливаются до ионов Fe2+. Через некоторое время продукты реакции можно обнаружить по характерным реакциям: иод – раствором крахмала, а ионы Fe2+ - раствором гексациано(II)феррата калия (красной кровяной соли) K3[Fe(CN)6].
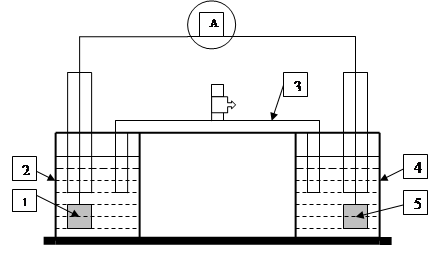
Рис 1.
Приведенная на рисунке схема представляет собой гальванический элемент, построенный на основе ОВР. Он состоит из двух полуэлементов: в первом протекает процесс окисления восстановителя:
2I- - 2ē = I2
а во втором – процесс восстановления окислителя:
Fe3+ + ē = Fe2+
Поскольку эти процессы протекают одновременно, то, умножив последнее уравнение на коэффициент 2 (для уравнивания числа отданных и присоединенных электронов) и суммируя почленно приведенные уравнения, получим уравнение реакции:
2I- + 2Fe3+ = I2 + 2 Fe2+
или
2KI + 2FeCl3 = I2 + 2FeCl2 + 2KCl
Всякая ОВР может служить источником электрического тока, если она протекает в гальваническом элементе.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5413; Нарушение авторских прав?; Мы поможем в написании вашей работы!