
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение изотермы химической реакции Вант-Гоффа, константа равновесия
|
|
|
|
Итак, на смещение химического равновесия влияют:
а) Т;
б) р;
в) с;
г) электрические и магнитные поля, другие факторы.
Химическая термодинамика позволяет количественно выразить эти влияния.
Пусть химическая реакция aA + bB → cC + dD протекает самопроизвольно в изобарно-изотермических условиях (p и T = const), причем А, В, С, D – идеальные газы. РА, РВ, РС, РD давление компонентов практически не меняется
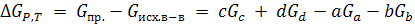 (6.1)
(6.1)
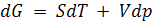
В изотермических условиях при Т = const
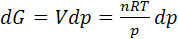 (6.2)
(6.2)
Интегрируя уравнение (6.2) от G0 до G и от р0 до р получим
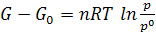
Или  (при p0 = 1 атм) (6.3)
(при p0 = 1 атм) (6.3)
Используя последнее уравнение получим:
 (6.4)
(6.4)
Индекс „нер.” Указывает, что давления компонентов равны их парциальным давлениям в неравновесной газовой смеси, а
 (6.5)
(6.5)
Уравнение (6.4) называется уравнением изотермы химической реакции, или изотермой Вант-Гоффа. Если pA = pB =pC =pD = 1атм., то ∆GP,T = ∆G0T
При p и T = const имеет место изобарно-изотермический процесс. В условиях термодинамического равновесия ∆GP,T = 0. В этом состоянии давления всех компонентов – равновесные, т.е.
 (6.6)
(6.6)
 (6.7)
(6.7)
Правая часть уравнения зависит только от температуры Т. Следовательно, и левая часть является постоянной при постоянной температуре. Она называется константой равновесия (Кр).
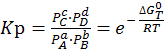 (6.8)
(6.8)
Константа равновесия выражена через равновесные давления компонентов.
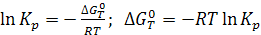 (6.9)
(6.9)
Последнее уравнение является частным случаем изотермы химической реакции. После оценки  термодинамическим способом можно рассчитать константу равновесия, не проводя эксперимента.
термодинамическим способом можно рассчитать константу равновесия, не проводя эксперимента.
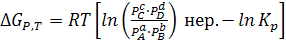 (6.10)
(6.10)
Если известна Кр, то можно оценить знак выражения в квадратных скобках последней формулы:
а) Первое слагаемое < второго, ∆Gp,T < 0, реакция самопроизвольно протекает слева направо;
б) Первое слагаемое > второго, ∆Gp,T > 0, протекает обратная химическая реакция;
в) Сумма в скобках = 0, ∆Gp,T = 0, имеет место состояние химического равновесия.
При р и V = const, изохорно-изотермический процесс, константа равновесия (Кс) выражается через равновесные концентрации компонентов. По аналогии с уравнением (6.4) имеем:
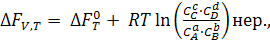 (6.11)
(6.11)
где  − изменение энергии Гельмгольца при параметрах V,T;
− изменение энергии Гельмгольца при параметрах V,T;
 – изменение энергии Гельмгольца при стандартных условиях.
– изменение энергии Гельмгольца при стандартных условиях.
В условиях химического равновесия при ∆FV,T = 0
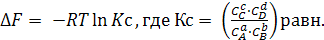 (6.12)
(6.12)
Константа Кс выражена через равновесные концентрации компонентов.
Полученные соотношения для констант Кр и Кс выражают закон действующих масс Гульдберга и Вааге.
Связь между Кр и Кс может быть установлена через уравнение состояния идеального газа:
 (6.13)
(6.13)
Следовательно 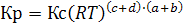 (6.14)
(6.14)
Кр = Кс, когда химическая реакция идет без изменения числа молей в газовой фазе, т.е. при c + d = a + b
Учитывая уравнение (6.11) и (6.12) получим
 (6.15)
(6.15)
Из уравнения изотермы (6.9) следует, что 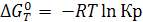
а) Если К < 1, 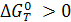 , реакция не протекает самопроизвольно в стандартных условиях. Принципиальная осуществимость процесса определяется знаком ∆G (в таблицах приводится значение ∆G0);
, реакция не протекает самопроизвольно в стандартных условиях. Принципиальная осуществимость процесса определяется знаком ∆G (в таблицах приводится значение ∆G0);
б) ∆G0  0, равновесие смещается в сторону распада химического соединения;
0, равновесие смещается в сторону распада химического соединения;
в) ∆G0  0, т.е. Кр очень велика и реакция осуществима не только в стандартных условиях, но и в любых других условиях.
0, т.е. Кр очень велика и реакция осуществима не только в стандартных условиях, но и в любых других условиях.
Расчет Кр по таблицам стандартных величин.
Константа равновесия Кр может быть рассчитана из термодинамических данных при стандартных условиях по формуле:
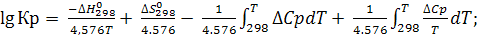 (6.16)
(6.16)
При расчете константы равновесия возможны три случая приближения:
1) Если ∆Ср =0, тогда ограничимся двумя первыми слагаемыми;
2) Если ∆Ср = ∆Ср298
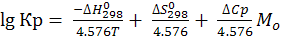 ; (6.17)
; (6.17)
где 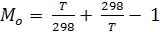
Величины Mo протабулированы (в зависимости от Т) в справочниках физико-химических величин.
3) ∆Ср – зависит от температуры и применяется первая расчетная формула (6.16)
Ниже приведены величины универсальной газовой постоянной R (в различных размерностях)
1) 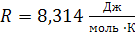
| 3) 
|
2) 
| 4) 
|
6.3. Описание равновесий в реальных системах.
Используя уравнение изотермы химической реакции Вант-Гоффа, закона действующих масс и др. можно описать равновесие в реальных системах, используя понятия летучесть, фугитивность (вместо давления), активность (вместо концентрации).
|
Если 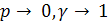
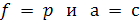
Учитывая это, уравнения (6.12) и (6.9) могут быть использованы для описания равновесий в реальных системах:
 (6.18)
(6.18)
 (6.19)
(6.19)
где f – летучести компонентов реакционной смеси,
а – активность компонентов реакционной смеси
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 9477; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 ↑ ↑
летучесть, активность
фугитивность
↑ ↑
летучесть, активность
фугитивность