
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость константы равновесия от температуры и давления
|
|
|
|
Для получения зависимости константы равновесия от температуры, уравнение изотермы подставляют в уравнение Гиббса-Гельмгольца. Зависимость константы равновесия от температуры выражается уравнениями изобары и изохоры химических реакций.
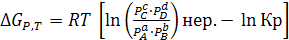 (6.20)
(6.20)
 (6.21)
(6.21)
Подстановка последнего выражения и (6.20) в уравнение Гиббса-Гельмгольца даёт:
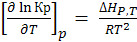 – уравнение изобары химической реакции (6.22)
– уравнение изобары химической реакции (6.22)
Аналогично можно получить уравнение изохоры химической реакции:
 – уравнение изохоры химической реакции (6.23)
– уравнение изохоры химической реакции (6.23)
Оба уравнения были выведены Вант –Гоффом. Из уравнения изобары химической реакции следует:
а) Если ∆Н < 0, реакция экзотермическая, Кр с ростом температуры уменьшается, а равновесие смещается справа налево;
б) Если ∆Н > 0, реакция эндотермическая, Кр растет с увеличением температуры, а равновесие смещается слева направо;
в) Если ∆Н = 0, то Кр не зависит от температуры.
При интегрировании последних уравнений нужно знать зависимость ∆Н и ∆U от температуры. При небольших изменениях Т, ∆Н и ∆U – величины постоянные, получим:
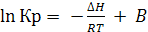 (6.24)
(6.24)
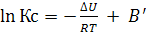 , (6.25)
, (6.25)
где B и B' – постоянные интегрирования.
Если известны Кр для нескольких температур, то построив график в координатах  можно определить тепловой эффект химической реакции и постоянную интегрирования (см. лекцию № 16).
можно определить тепловой эффект химической реакции и постоянную интегрирования (см. лекцию № 16).
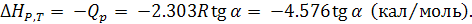 (6.26)
(6.26)
Известно, что Кс = Кр (RT)-∆H, где ∆Н – изменение числа молей вещества при протекании реакции в газовой фазе. Константа равновесия не зависит от давления. Таким образом, для реакций, участники которых ведут себя как идеальные газы, Кр и Кс от давления не зависят. Однако, состав равновесной смеси может зависеть от давления. Выход продуктов реакции при равновесии удобно характеризовать величиной КN
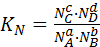 , (6.27)
, (6.27)
где N – мольные доли участников реакции
Связь между Кр и КN осуществляется через уравнение
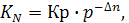 (6.28)
(6.28)
где р – общее давление газовой смеси
Если взять натуральный логарифм от обеих частей уравнения (6.28) и продифференцировать по общему давлению при Т =const, получим
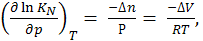 (6.29)
(6.29)
где ∆V – изменение объема в результате реакции
Таким образом, если ∆n > 0 повышение давления приводит к уменьшению KN, т.е. при повышении давления равновесие химической реакции смещается в сторону уменьшения объема (иллюстрация известного принципа Ле Шателье).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 6473; Нарушение авторских прав?; Мы поможем в написании вашей работы!