
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Д. И. Менделеева
|
|
|
|
Периодический закон и периодическая система элементов
Свойства атомов.
Периодический закон и периодическая система Д. И.Менделеева.
СВОЙСТВА АТОМОВ
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА.
1) Закон Менделеева. Закон Мозли.
2) Периодичность свойств элементов в периодической системе. Вторичная периодичность и диагональное сходство.
3) Строение периодической системы элементов Д.И.Менделеева
1) В своей классической формуле закон был эмпирическим и это признавал сам Менделеев, т.к. закон не опирался на математический аппарат,не вскрывал причину периодичности свойств элементов, некоторые атомы элементов не соответствовали атомной массе размещенной в таблице.В 1914 г. Исследуя спектр рентгеновских излучений Мозгли установил, что все последующие элементы за атомом Н2 по своему спектру напоминают спектр атома Н2, только спектральные линии удаляются в более коротковолновую область. Мозли выводит √ из частоты характеристического спектра атома элемента пропорционального порядковому номеру Эл-та 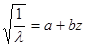 .
.
Работы Чадвига и Резерфорда подтвердили правильность закона Мозли. Действительно свойства элементов и их соединений измеряются по мере возрастания заряда ядер атомов. Периодический закон Менделеева нашел новую формулировку: свойства простых тем, а так же свойства их соединений находятся в периодической зависимости от порядкового номера атомов. Но закон оставался эмпирический. Закономерности изучения электронного строения атома позволили приобрести закону математический аппарат. При сопоставлении элементов и правил электронного строения атомов в периодической системе обнаружены следующие закономерности:
1) Номер периода соответствует n (главному квантовому числу)
2) На внешнем энергетическом уровне суммарное количество ē равно 8 (s² p6)
3) На предвнешнем энергетическом уровне общее количество ē равно 18 (s²pd¹º)
4) Максимальное число ē определяется формулой 2 n²
5) Свойства атомов элементов зависит от периодического изменения электронной структуры атомов.
2) Если рассматривать электронные структуры атомов в группах,то наблюдается явление которое называется электронная аналогия элементов. Различают полные и неполные электронные аналогии. Например: 5гр N 1 s² 2 s² 2 p³ максимальная валентность 3, т.к. у N отсутствует d подуровень. P 1 s² 2 s² 2 p6 3 s² 3 p³ максимальная валентность 5, т.к. в возбужденном состоянии электрон с 3 s nодуровня. переходят на свободную орбиталь 3 d nодуровня. Хотя ē конфигурация внешних наружных уровней N и P одинакова. Эти элементы неполными ē аналогами.
P и As (мышьяк) -полное ē аналоги, т.к. у них есть свободный d nодуровень. P и V -неполные ē аналоги, т.к. в переходе участвуют электроны разных n/уровней. По мере заполнения электронами у d и f элементов в атомной системе резко проявляются эффекты проникновения электронов в ядро, по этому для d и f элементов присуща вторичная или внутренняя периодичность. При этом отмечено, что атомный радиус элементов изменяется незначительно.
Например:у лантанидов, начиная от Эл-та и кончая атомные радиусы изменяются примерно на 0,3 нм, количество ē возрастает значительно, поэтому от церия до тербия 4 f подуровень заполняется наполовину (max f 7),а затем до гафния происходит спаривание ē до f 14-происходит так называемое «лантоидное сжатие»,которое оказывает большое влияние на свойства последующих элементов.
Исключением из правила Клечковского являются лантан и актиний. У этих элементов вместо 4 f и 5 f заполняется подуровень 5 d и 6 d. Это связано с особенностями распределения электронной плотности на 4 и 5 уровнях.
3) Первый период состоит из 2-х элементов: водорода и гелия. У водорода ē находится на первом энергетическом уровне, электронная формула - 1 s1, s - электронные облака имеют форму шара. В соответствие с принципом Паули на 1 орбитали может находится 2 ē, следовательно, у гелия 1 s2.
2 и 3 периоды содержат по 8 элементов. У элементов 2 периода заполняется 2-ой слой (n=2), сначала 2 s орбиталь, а затем последовательно 3 2p- орбитали.
У неона Ne – 8 внешних ē образуют высокосеммитричную структуру из 4-х устойчивых двухэлектронных облаков. У атомов Na, P и Ar заполняются соответственно 3s1, 3p3 и 3 p6 подуровни. 3d – орбитали остаются свободными.
Элементы у которых последним заполняется s- подуровень – s-элементы, а те, у которых последний p- подуровень – p-элементы.
4 и 5 периоды содержат по 18 элементов. В 4 периоде начинают заполнятся 4- s- орбиталь при свободной 3d – орбитали, так как это более выгодно энергетически. Далее начиная со скандия (Sc) начинают заполняться 3d орбитали (более энергетически выгодно)- так называемые d – элементы, а после них - заполняется 4- p подуровень. Аналогично и в 5 – ом периоде.
6 период содержит 32 элемента и 7 – незаконченный (25-27 элементов).
В 6 периоде начинает заполнятся после 6s – подуровня 4f- подуровень - лантаниды (церий – лютеций (Ce-Lu)). – f элементы. Потом заполняется 5d - подуровень, так как это более энергетически выгодно. В 7 периоде – после 7s заполняется 5f – подуровень – Актиниды (Th-Lr).
По мере роста заряда ядра происходит закономерная периодическая повторность сходных электронных структур, а следовательно и повторяемость свойств элементов.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!