
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
Электролиз-совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
При электролизе химическая реакция осуществляется за счет энергии электрического тока. На катоде, отрицательно заряженном электроде (-), происходит процесс восстановления, на аноде, положительно заряженном электроде (+) - процесс окисления. Восстановительное и окислительное действие электрического тока сильнее действия химических восстановителей и окислителей. Прибор, в котором проводят электролиз, называется электролизёром или электролитической ванной. На характер течения электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и т.д.).
Различают электролиз расплавов и растворов электролитов. В последнем случае в процессе электролиза будут участвовать молекулы воды.
Электролиз расплавов. Если в расплав хлорида натрия погрузить инертные электроды (угольные, железные) и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ к катоду, анионы Cℓ- - к аноду.
Окисление происходит на аноде Восстановление происходит на катоде
(слова начинаются с гласных «а») (слова начинаются с согласных «к»)
Анионы – отрицательно заряженные ионы Катионы – положительно заряженные ионы
Ионы натрия Na+, достигнув катода, принимают от него электроны и восстанавливаются; ионы хлора Сl-, отдав электроны аноду, окисляются. Суммарное уравнение электролиза
NaСl → Nа+ + Cℓ-
(-) катод: Nа+ Nа+ + е → Na
(+) анод: Сℓ- 2Сℓ- - 2е → Сℓ2
Суммарная схема процесса электролиза расплава NаСℓ
2NаСℓ → 2Na + Сℓ2.
При электролизе расплавов, содержащих кислородсодержащие анионы, на аноде выделяется кислород. Это объясняется образованием при окислении на аноде неустойчивых частиц ОН-, SО42- и т.д., сразу разлагающихся на устойчивый оксид неметалла и кислород. Схема электролиза расплава сульфата натрия может быть представлена следующим образом
Na2S04 → 2Nа+ + SО42-
(-) катод: Nа+ 2Nа+ + 2е → 2 Nа
(+) анод: SО42- SО42- - 2е → SО3 + ½О2
Суммарная схема процесса электролиза расплава Na2S04
Na2S04 → 2Nа + SО3+½О2.
Электролиз растворов. При рассмотрении электролиза водных растворов следует иметь в виду, что кроме молекул электролита, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. В этом случае нужно учитывать величину потенциала процесса восстановления ионов водорода, который зависит от концентрации Н+. В нейтральной среде его значение равно -0,41 В. Последовательность разрядки катионов при электролизе можно установить с помощью электрохимического ряда напряжений. Возможны три случая:
1. Катионы металлов, имеющие величину потенциала значительно более отрицательную, чем -0,41 В (потенциал выделения водорода) не восстанавливаются на катоде (от лития до алюминия включительно), а восстанавливаются молекулы воды;
2. Катионы металлов, имеющие значения стандартных электродных потенциалов близких к значению потенциала выделения водорода (металлы средней части ряда Zn, Сr, Fе, Сd, Ni) восстанавливаются на катоде одновременно с молекулами воды;
3. Катионы металлов, имеющие стандартный электродный потенциал больший, чем потенциал выделения водорода, при электролизе практически полностью восстанавливаются на катоде.
Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде будет протекать в порядке уменьшения алгебраической величины стандартного электродного потенциала. Так, из смеси катионов Аg+, Сu2+, Fе2+ первыми будут восстанавливаться катионы серебра (Ео = + 0,80 В), затем катионы меди (Ео = + 0,34 В) и последними - катионы железа (Ео = - 0,44 В). Характер реакций протекающих на аноде зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Различают нерастворимые и растворимые аноды. Нерастворимые аноды изготавливают из графита, платины. При электролизе нерастворимые аноды не посылают электроны во внешнюю цепь, их пополнение осуществляется в результате окисления анионов или молекул воды. При этом анионы бескислородных кислот при их достаточной концентрации окисляются довольно легко. Если же раствор содержит анионы кислородсодержащих кислот (SO42-, NO3-, СО32-, PO43- и др.), то на аноде окисляются не эти ионы, а молекулы воды.
В зависимости от рН растворов окисление воды протекает по разному. В щелочной среде имеет место реакция 4ОН- - 4е = О2 + 2Н2О.
В кислой или нейтральной среде 2Н2О + 4е = O2 + 4Н+.
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление протекает при очень высоких потенциалах. Например, потенциал окисления ионов SО42-
2SO42- + 2е = S2O82-.
равен 2,01 В, что значительно превышает потенциал окисления воды 1,23 В.
В случае нерастворимого анода электроны во внешнюю цепь посылает сам анод. Растворимые аноды изготавливают из меди, серебра, цинка, кадмия и др.
Рассмотрим несколько примеров электролиза водных растворов электролитов. Электролиз концентрированного раствора иодида калия с угольными электродами.
В растворе находятся гидротированные ионы К+ и J-, а так же молекулы воды. При прохождении тока через раствор катионы К+ движутся к катоду, анионы J- - к аноду. Однако реакции, протекающие на электродах, существенно отличаются от реакций, идущих в расплаве соли. Так, на катоде вместо ионов калия (в ряду напряжений он находится до алюминия) восстанавливаются молекулы воды. Схема электролиза раствора КJ с угольными электродами представлена на рисунке.
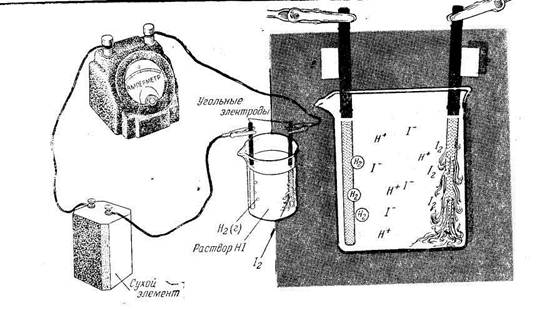
Схема процесса электролиза КJ (раствора)
Схема электролиза КJ → К+ + J-
(-) катод: К+, Н2О 2Н2О +2е → Н2 + 2ОН-
(+) анод: J-, H2O 2J- - 2е → J2
Суммарная схема процесса электролиза 2 КJ + 2Н2О → Н2↑ + 2КOH + J2↑.
В результате электролиза на катоде выделяется водород на аноде - йод, в прикатодном пространстве накапливается гидроксид калия.
Электролиз раствора сульфата калия с угольными электродами. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет восстанавливаться вода, выделяться водород и накапливаться ионы ОН-. У анода выделяется кислород и накапливаются ионы Н+. При перемешивании раствора он будет нейтральным. Схема электролиза

Суммарная схема процесса электролиза

Электролиз водного раствора сульфата калия сводится к электролизу воды

|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1212; Нарушение авторских прав?; Мы поможем в написании вашей работы!