
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическое разложение воды
|
|
|
|
Количество растворенной соли остаeтся постоянным. В рассмотренном примере К2SО4 выполняет роль электролита.
Электролиз раствора сульфата цинка с инертными электродами. На катоде одновременно восстанавливаются ионы цинка и молекулы воды (электродный потенциал цинка -0,76 В близок к потенциалу разложения воды -0,41 В). На аноде окисляются молекулы воды и выделяется кислород.
Схема электролиза ZnSО4 —>Zn2+ +SO42-
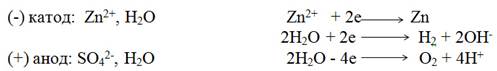
Суммарная схема процесса электролиза

Электролиз раствора нитрата меди с инертными электродами. Стандартный электродный потенциал Сu +0,34 В, поэтому на катоде восстанавливаются ионы Сu2+ и выделяется медь. На аноде окисляются молекулы воды и выделяется кислород. Схема электролиза
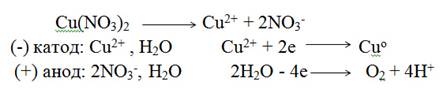
Суммарная схема процесса электролиза

Электролиз раствора сульфата никеля с никелевым анодом. Стандартный электродный потенциал Ni -0,25 В. Он несколько больше, чем потенциал разложения воды (-0,41 В), поэтому на катоде в основном происходит восстановление ионов Ni2+ и выделение металла. На аноде - противоположный процесс - окисления металла, так как потенциал никеля намного меньше потенциала окисления воды (1,23 В) и потенциала окисления SO42- ионов (2,01 В). Электролиз в данном случае сводится к растворению металла анода и выделению его на катоде. Схема электролиза
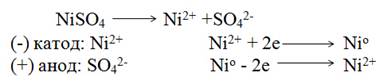
Электролиз может происходить только при определенной разности потенциалов, называемой потенциалом разложения. Потенциал разложения - минимально необходимая разность потенциалов, при которой начинается электролиз данного соединения.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1656; Нарушение авторских прав?; Мы поможем в написании вашей работы!