
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осложнения ГБ
|
|
|
|
ЛЕКЦИЯ
Обратимые реакции.
к1
А +В ↔ С + D
к2
 С Изменение концентрации веществ
С Изменение концентрации веществ
во времени исходных и конечных.
 t
t
Концентрация исходных веществ убывает до определенного момента.
1 – изменение концентрации исходных веществ.
2– изменение концентрации конечных продуктов во времени.
В момент равновесия Vпрямой = Vобратной, применив закон действующих масс:
К1[A] [B] = K2 [C] [D]
K = K0 * e –Е/RT
Главным в этом уравнении – это определение Е активации.
Для сложных реакций теория активных столкновений страдает рядом недостатков.
Оказалось, что экспериментальная константа скорости намного меньше теоретической, и это объясняется упрощенным характером теории, где соударение молекул похоже на столкновение шаров, где предполагается, что химическое взаимодействие происходит в момент столкновения.
Для того чтобы сделать уравнение применимым к эксперименту в него был введен поправочный коэффициент Р - стерический фактор (ориентация молекул в пространстве).
К = Р * K0 * e –Е/RT, поэтому теория активных столкновений оправдывает себя для реакций в газовой фазе.
В 1935 году Эйринг и Поляни представили теорию активированного комплекса (ТАК) или теорию переходного состояния.
Теория исходит из движения молекул и преодоления энергетического барьера. Однако она предполагает, что химическое взаимодействие осуществляется не в резкльтате столкновения, а в результате образования некторого промежуточного комплекса, в котором постепенно изменяются межатомные состояния, перераспределяется энергия по связям и конфигурация исходных веществ постепенно переходит в конфигурацию конечных продуктов.
А2 + В2 à 2 АВ
А –А А… А А А
+ à:: à +
В – В ß В… В В В
активный
комплекс
Е0 – энергия активации прямой реакции.
Разница энергий активированного комплекса и исходных веществ и есть
Е активации. Эта теория выражается так:
КБ * Т
К = h * е Sо*/R * e - ∆Ho*/RT (формула Болезена)
КБ – константа Больцмана
h - константа Планка
S0* - энтропия активированногго комплекса
Н0* - стандартная энтальпия
Сопоставим это уравнение с уравнением Аррениуса:
К = К0 * е –Е/RT, т.е. получится, что Е ≈ Н0*
К0 связана с ∆S0* (энтропией), поэтому через К0 можно рассчитать ∆S0*. Эта теория работает в водных растворах.
Определение Е активации.
I способ – графический.
Здесь определяют значение К при разных температурах, строят график зависимости ln K от 1 /T и находят тангенс угла наклона этой линии.
К = К0 * Е –Е /RT
E 1
ln К = ln K0 - R * T * X
y = b + kx (уравнение I порядка в матем.)
II способ – аналитический.
Здесь достаточно знать К всего при двух температурах.
Составляется система уравнений.
E
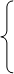 ln K T1 = ln Ko – RT1
ln K T1 = ln Ko – RT1
E
ln KT2 = ln Ko – RT2
Вычитая из одного другое, приходим к следующему уравнению.
E E E
ln KT1 – ln KT2 = (ln Ko - RT1) – (ln Ko – RT2) = ln Ko – RT1 –
E E E E E
ln Ko + RT2 = - RT1 + RT2 = RT2 - RT1
KT1E
ln KT2 = R * (1 / T2 – 1 / T1)
KT1
E = R * ln KT2
1 _ 1
T2 T1
КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ
Скорость химической реакции при данной температуре определяется скоростью образования активированного комплекса, которая, в свою очередь, зависит от величины энергии активации. Во многих химических реакциях в структуру активированного комплекса могут входить вещества, стехиометрически не являющиеся реагентами; очевидно, что в этом случае изменяется и величина энергии активации процесса. В случае наличия нескольких переходных состояний реакция будет идти в основном по пути с наименьшим активационным барьером.
Катализ – явление изменения скорости химической реакции в
присутствии веществ, состояние и количество которых после
реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьщение скорости реакции), хотя часто под термином «катализ» подразумевают только положительный катализ; отрицательный катализ называют ингибированием.
Вещество, входящее в структуру активированного комплекса, но стехиометрически не являющиеся раегентом, называется катализатором. Для всех катализаторов характерны такие общие мвойства, как специфичность и селективность действия.
Каталитические реакции имеют ряд характерных особенностей.
1) Катализатор, участвуя в промежуточных стадиях, выделяется в первоначально взятом количестве и в свободном виде в конце реакции.
2) По сравнению с массами реагирующих веществ количество введенного катализатора ничтожно мало; например 1 кг платино-родиевой сетки (катализатор) способствует окислению в лкись азота 1 000 000 кг аммиака NH3.
3) Катализатор в одинаковой мере действует на скорость прямой и обратной реакций, т.е. смещения равновесия химической реакции при введении катализатора не наблюдается.
4) Действие катализаторов отличается специфичностью, а именно: данный катализатор, как правило, может влиять только на одну из реакций, не оказывая действия на другие. Действие катализатора характеризуется активностью (т.е. способностью ускорять процесс) и селективностью (т.е. способностью проводить процесс в определенном направлении).
Аl2O3
С2Н5ОН -------à С2Н4 + Н2О
3500С
Аl2O3
------à C2H5OC2H5 + H2O
2500C
Na
------à C4H4OH + H2O
Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
5) Посторонние вещества по отношению к катализаторам могут быть нейтральными, полезными или вредными.
Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты:
[Cu]: СО + Н2 → СН3ОН [Al2O3]: С2Н5ОН → С2Н4 + Н2О
[Ni]: СО + Н2 → С2Н4 + Н2О [Cu]: С2Н5ОН → СН3СНО + Н2
Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции через активированный комплекс с участием катализатора.
Поскольку, согласно уравнению Аррениуса, константа скорости химической реакции находится в экспоненциальной зависимости от величины энеергии активации, уменьшение псоледней вызывает значительное увеличение константы скорости. Действительно, если предположить, что предэкспоненциальные множители в уравнении Аррениуса для каталитической некаталитической реакции близки, то для отношения скорости можно записать:
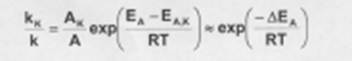
Если ∆ЕА = -50кДж/моль, то отношение констант скоростей составит 27 *105 раз (действительно, на практике такое уменьшение ЕА увеличивает скорость реакции приблизительно в 105 раз).
Необходимо отметить, что наличие катализатора не влияет на величину изменения термодинамического потенциала в результате процесса и, следовательно, никакой катализатор не может сделать возможным самопроизвольно протекание термодинамически невозможного процесса (процесса, ∆G (∆F) которого больше нуля). Катализатор не изменяет величину константы равновесия для обратимых реакций; влияние катализатора в этом случае заключается только в ускорении достижения равновесного состояния.
В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ.

Рис. Энергетическая диаграмма химической реакции без
катализатора (1) и в присутствии катализатора (2).
Гомогенный катализ.
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов катализатор образует с реагентами промежуточные реакционноспособные продукты. Рассмотрим некоторую реакцию
А + В → С
В присутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активизированный комплекс АВК#) конечный продукт реакции с регенацией катализатора:
А + К → АК
АК + В → С + К
Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой ЕА = 190 кДж/моль:
СН3СНО → СН4 + СО
В присутствии паров йода этот процесс протекает в две стадии:
СН3СНО + I2 → CH3I + HI + CO
CH3I + HI → СН4 + I2
Уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль; константа скорсоти реакции при этом увеличивается приблизительно в 105 раз. Наиболее распространенным типом гомогенного катализа является кислотный катализ, при котором в роли катализатора выступают ионы водорода Н+.
Пример: башенный способ получения серной кислоты Н2SO4, при котором окисление SO2 в SO3 кислородом воздуха каталилизируется газообразными окислами азота (NO и NO2) и сопровождается образованием ряда промежуточных продуктов:
SO2 + NO2 à SO3 + NO
NO + 1 / 2 O2 à NO2
или суммарно:
SO2 + 1/ 2 O2 à SO3
Гетерогенный катализ
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа. В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:
А + В + К → АВК
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):
АВК → АВК#
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:
АВК# → CDK
5. Десорбция продуктов реакции с поверхности катализатора.
CDK → C + D + K
6. Диффузия продуктов реакции от поверхности катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Напрмиер, для катализируемой металлическим никелем реакции
СО + Н2 → СН4 + Н2О
Введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т.н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.
Для объяснения этих особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано следующее предположение: каталитически активной является не вся поверхность катализатора, а лишь некоторые ее участки – т.н. активные центры, которыми могут являться различные дефекты кристаллической структуры катализатора (например, выступы либо впадины на поверхности катализатора). В настоящее время нет единой теории гетерогенного катализа. Для металлических катализаторов была разработана теория мультиплетов. Основные положения мультиплетной теории состоят в следующем:
1. Активный центр катализатора представляет собой совокупнсоть определенного числа адсорбционных центров, расположенных на поверхности катализатора в геометрическом соответствии со строением молекулы, претерпевающей превращение.
2. При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перераспределение связей, приводящее к образованию продуктов реакции.
Теорию мультиплетов называют иногда теорией геометрического подобия активного центра и реагирующих молекул. Для различных реакций число адсорбционных центров (каждый из которых отождествляется с атомом металла) в активном центре различно – 2,3,4 и т.д. Подобные активные центры называются соотвественно дублет, триплет, квадруплет и т.д. (в общем случае мультиплет, чему и обязана теория своим названием).
Например, согласно теории мультиплетов, дегидрирование предельных одноатомных спиртов происходит на дублете, а дегидрирование циклогексана – на секстете (рис.2.10-2.11); теория мультмплетов позволила связать каталитическую активность металлов с величиной их атомного радиуса.

Ферментативный катализ.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы.
Ферменты или энзимы – специфические белки, выполняющие каталитические функции в живых системах.
Особенности ферментативного катализа: все процессцы в организме идут при t = 370С, а вне организма при t = 4000С.
Каждый фермент катализирует только одну реакцию.
Ферменты действуют в узком интервале рН.
Пример: трипсин способен проявлять свою активность от 8 до 8,5 рН.
пепсин - от 1,5 до 2 рН.
Ферменты работают в определенной области температур. При понижении температуры активность ферментов снижается, но при восстановлении оптимальных температур активность восстанавливается (такой вид используется при операциях на грудной клетке, t0 – понижают до 22ОС).
При повышении t0С активность фермента увеличивается, но до некоторого предела, т.к. выше – происходит денатурация белков, инактивация фермента и выход его из строя.
Ферментативный катализ имеет две характерные особенности:
1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами. Так, константа скорости реакции разложения перекиси водорода, катализируемой ионами Fe2+, сотавляет 56 с-1; константа скорости этой же реакции, катализируемой ферментом каталазой, равна 3,5 *107,т.е. реакция в присутствии фермента протекает в миллион раз быстрее (энергии активации процессов составляет 42 и 7,1 кДж/моль). Константы скорости гидролиза мочевины в присутствии кислоты и уреазы различаются на принадцать порядков, составляя 7,4 * 10-7 и 5 * 106 с-1 (величина энергии активации составляет соответственно 103 и 28 кДж/моль).
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного ферментов.
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент F находится в равновесии с очень быстро образующимся фермент-субстратным комплексом FS, который сравнительно медленно распадается на продукт реакции Р с выделением свободного фермента; т.о., стадия распада фермент – субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
Механизм действия катализаторов – ферментов:
S + F = S F ---------à P + F
субстрат фермент
(энзим) продукт
энзимсубстратный
комплекс
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться (рис.2.12) и зависимость скорости реакции от концентрации субстрата описывается следующим уравнением:
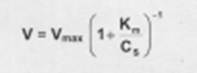
Здесь Кm – константа Михаэлиса, численно равная концентрации субстрата при V = ½ Vmax. Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше Кm, тем больше их способность к образованию фермент-субстратного комплекса.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям –рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значен6ии рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.

Автокатализ.
Автокатализ – процесс каталитического ускорения химической реакции одним из ее продуктов.
Пример: Можно привести катализируемую ионами водорода реакцию гидролиза сложных эфиров. Образующаяся при гидролизе кислота диссоциирует с образованием протонов, которые ускоряют реакцию гидролиза.омыление сложных эфиров в отсутствие в в реакционной смеси кислоты.
СН3 СООС2Н5 + Н2О → СН3 СООН + С2 Н5ОН
Особенность автокаталитической реакции состоит в том, что данная реакция протекает с постоянным возрастанием концентрации катализатора. Поэтому в начальный период реакции скорость ее возрастает, а на последующих стадиях в результате убыли концентрации реагентов скорость начинает уменьшаться; кинетическая кривая продукта автокаталитической реакции имеет характерный S – образный вид (рис).

Работа катализа.
Если скорость реакции увеличивается, то катализ называется положительным. Если скорость реакции уменьшается, то катализ называется отрицательным.
- ГК – резкое повышение АД с нарушением ритма и интенсивности кровоснабжения мозга, может привести к инсульту – кровоизлиянию в мозг.
- Инсульт (апоплексия, мозговой удар) – острое нарушение мозгового кровообращения с повреждением тканей мозга и расстройством его функций - кровоизлияние в мозг.
- СН – застой крови, появление отеков.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!