
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белки, пептиды и аминокислоты мяса
|
|
|
|
Массовая доля влаги в некоторых пищевых продуктах
ВОДА И ЕЕ СОСТОЯНИЕ В МЯСЕ И МЯСНЫХ ПРОДУКТАХ
Вода – важнейший компонент всех пищевых продуктов. Воду нельзя рассматривать просто как инертный компонент или универсальный растворитель для пищевых веществ. Она является не только преобладающим компонентом большинства пищевых продуктов, но и оказывает предопределяющее влияние на многие их качественные характеристики, особенно на сроки хранения.
Массовая доля влаги в мясе и мясных продуктах колеблется в широких пределах (табл. 2.1).
Таблица 2.1
| Массовая доля влаги, % | Продукт |
| 40–70 | Копчености, свежие сосиски, ветчина, окорок, ливерная колбаса и немецкие колбаски |
| 50–60 | Жирное мясо |
| 70–80 | Свежие бобовые (фасоль, бобы, горох) и мясо (говядина, баранина, конина, птица). Рыбные продукты (рыба, моллюски, ракообразные) |
Влага смачивания и влага макропор имеет весьма непрочную связь с продуктом и может быть удалена механическими способами (отжатием на прессах или под действием центробежной силы в центрифугах). Такая влага называется свободной. Свободную влагу также можно удалить путем высушивания или вымораживания.
Свободная влага, являясь растворителем органических и неорганических соединений, участвует во всех биохимических процессах, протекающих при хранении и переработке мясного сырья.
Поступающие с пищей белки в организме человека выполняют важнейшие функции. Белки содержатся во всех продуктах питания, но массовая доля их весьма различна. Например, в мясе – 18–22 мас. %, рыбе – 17–20, яйце – 20–36, молоке – 3,5, ржаном хлебе – 7,8 мас. %.
Белки состоят из 20 аминокислот, 10 из которых могут синтезироваться в организме и называются заменимыми; 10 аминокислот в организме из других аминокислот не синтезируются, поэтому они называются незаменимыми.
|
|
|
Белки, содержащие все незаменимые аминокислоты, называют полноценными. Если в белке нет хотя бы одной незаменимой аминокислоты, то он считается неполноценным. Постоянная нехватка полноценного белка в пище ведет к возникновению анемии, отечности тканей, развитию дегенеративных изменений почек, печени и поджелудочной железы, нарушению умственных способностей, вызывает тяжелые необратимые нарушения физиологических функций.
Большинство белков мяса относится к полноценным, что делает их обязательным компонентом пищи.
В состав мяса и мясопродуктов входят простые и сложные белки, в том числе водо-, соле- и щелочерастворимые, обеспечивающие удержание воды, набухаемость и растворимость, а также сложные белки-пигменты, отвечающие за цвет продукта. Белки различаются не только химическим и пространственным строением, но и размерами частиц, а также формой молекул. Последняя включает две группы – фибриллярные и глобулярные, отличающиеся физико-химическими свойствами.
Белки мяса и мясопродуктов принято разделять по морфологическому признаку клеток мышечных тканей животных (рис. 2.4). Саркоплазматические, миофибриллярные белки и белки стромы обеспечивают функциональность пищевой системы в получении мясопродуктов, а группа ядерных белков самостоятельного технологического значения не имеет.
Фракция суммарных белков саркоплазмы составляет 20–25 % количества всех мышечных белков. Белки саркоплазмы способны образовывать гель, особенно в присутствии АТФ. При высоких концентрациях Са2+ гель разжижается.
Миоген представляет собой комплекс миогенов А, В и С, различающихся кристаллической формой. Обычно под миогеном подразумевается вся миогеновая фракция. Миоген составляет около 20 % всех белков мышечного волокна. Он растворяется в воде, образуя гомогенные растворы небольшой вязкости с массовой долей 20–30 %. Температура денатурации свободного от солей миогена 55–60 0С, изоэлектрическая точка (ИЭТ) лежит в интервале рН 6,0–6,5. С течением времени часть миогена переходит в нерастворимое состояние.
|
|
|
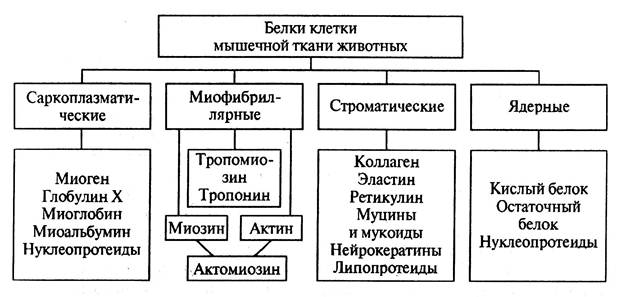
Рис. 2.4. Белки мышечной ткани животных
Миоальбумины составляют около 1 –2 % белков мышечного волокна. Растворимы в воде и нерастворимы в кислой среде, так как имеют изоэлектрическую точку около рН 3,0–3,5; температура денатурации 45–47 °С.
Глобулин X составляет около 20 % общего количества белковых веществ мышечного волокна. Растворим в солевых растворах даже очень низкой концентрации, температура денатурации при рН 6,5 около 50 °С, при рН 7,0 – около 80 °С, изоэлектрическая точка лежит в интервале рН 5,0–5,2.
Миоглобин – хромопротеид, составляющий в среднем 0,6–1,0 % общего количества белков. Он состоит из белковой части – глобина и простетической группы – гема. На одну молекулу миоглобина приходится одна группа тема. В миоглобине не обнаружено цистина. Миоглобин хорошо растворим в воде. Температура денатурации около 60 °С. Денатурация миоглобина сопровождается отщеплением простетической группы. Миоглобин способен присоединять оксид азота, сероводород и кислород за счет дополнительных связей. В последнем случае образуется оксимиоглобин светло-красного цвета, который переходит с течением времени в метмиоглобин коричневого цвета. При этом железо отдает один электрон. При действии восстановителей метмиоглобин снова образует миоглобин. Последний окрашен в пурпурно-красный цвет и обусловливает естественную окраску мышечной ткани, интенсивность которой зависит от его содержания и соотношения форм пигментов белка. Изменение цветности мяса и мясопродуктов (рис. 2.) происходит под влиянием микрофлоры, теплового воздействия, посола, света и других факторов. Количество пигментов, глубина их превращений и образование форм соответствующей окраски играют значительную роль в получении продуктов высокого качества. При переходе миоглобина в метмиоглобин пурпурно-красная окраска мяса меняется на коричневую. Она наиболее заметна, когда в мет-форму переходит более 50 % миоглобина. Это свойство широко используется для определения сроков хранения мяса путем выявления соотношения различных спектральных форм миоглобина, а также при регулировании цветности мясопродуктов.
|
|
|
Миозин – фибриллярный белок, составляет около 40 % белков клетки мышечной ткани. Гетерогенен. Обычно под миозином подразумевается вся миозиновая фракция. Миозин – полноценный, хорошо переваримый белок. Молекулярная масса миозина скелетных мышц около 500 000 (для миозина кролика 470 000). Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с молекулярной массой 205 000-210 000 и несколько коротких легких цепей, молекулярная масса которых около 20 000. тяжелые цепи образуют длинную закрученную a-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в головке миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу. Количество легких цепей в молекуле миозина у разных видов животных и в разных типах мышц неодинаково.
Совершенно чистый миозин растворим в воде и образует вязкий раствор с массовой долей до 4 % белка. Растворы солей щелочных металлов небольшой молярной концентрации (0,25– 0,04 моль/дм3) осаждают миозин из его растворов; в солевых растворах повышенной молярной концентрации (до 0,6 моль/л) он растворяется. Температура денатурации миозина около 45– 50°С (у птицы около 51 °С); изоэлектрическая точка определяется при рН 5,4. Биологические функции миозина связаны с координированным движением живых организмов и автолитическими превращениями мышечных тканей после убоя животных.
Актин составляет 12–15 % всех мышечных белков и является основным компонентом тонких нитей. Этот белок существует в двух формах – глобулярной (G-форма) и фибриллярной (F-форма).
|
|
|
В растворах с низкой ионной силой актин существует в виде мономера с относительной молекулярной массой около 47 000. При повышении ионной силы раствора до физиологического уровня G-актин полимеризуется в F-актин, очень похожий на нить. Г-актин (G-актин) представляет собой одну полипептидную цепочку, сложенную в глобулу. Быстрая полимеризация актина происходит также при добавлении ионов Mg2+. При этом образуется двунитчатая спираль, каждая составляющая в которой напоминает нить бус, закрученных одна вокруг другой. Актин относится к полноценным и легкоусвояемым белкам.
Актомиозин – это сложный комплекс, который формируется при добавлении раствора актина к раствору миозина и сопровождается увеличением вязкости раствора. Каждая нить F-актина может связывать большое число молекул миозина. Содержание актомиозина указывает на глубину автолитических превращений в процессе трупного окоченения и позволяет опосредованно судить о функциональности мясного сырья в процессе технологической обработки.
Тропомиозин – белок палочковидной формы с относительной молекулярной массой около 70 000, постоянно присутствующий в структуре тонких (актиновых) филаментов. Биологическая роль тропомиозина сводится к регулированию взаимодействия актина и миозина в процессе мышечного сокращения. Массовая доля тропомиозина составляет 10–12 % всех белков миофибрилл или 2,5 % белков мышц. Растворим в воде, но из мышечной ткани водой не извлекается. Изоэлектрическая точка определяется при рН 5,1.
Тропонин представляет собой сферическую молекулу с относительной молекулярной массой 76 000, включающей три субъединицы, аминокислотный состав которых полноценен. В склетных мышца взрослого животного тропонин составляет лишь около 2 % миофибриллярных белков. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ (рис. 2.7).
Нуклеопротеиды играют первостепенную роль в жизнедеятельности организма, в частности в явлениях наследственности. Простетической группой нуклеопротеидов служат нуклеиновые кислоты. Они нерастворимы в воде, но растворяются в щелочах. В их состав входит простой белок, как правило протамин или гистон. При полном гидролизе нуклеопротеидов образуются a-аминокислоты, рибоза и дезоксирибоза, фосфорная кислота и азотистые основания (пуриновые и пиримидиновые). Массовая доля нуклеопротеидов в мышечной ткани составляет 0,207–0,245 %, где они входят в состав рибосом и саркоплазматического ретикулума. В основном это рибонуклеопротеиды, функции которых связаны с синтезом белков. Нуклеопротеидами богаты ткани мозга, где они представлены нейроглобулином (дезоксирибонуклеопротеидом) и нейро-стромином (рибонуклеопротеидом). Нуклеопротеиды являются полноценными белками, однако, как отмечалось выше, самостоятельного технологического значения не имеют и входят в состав мышечных клеток.
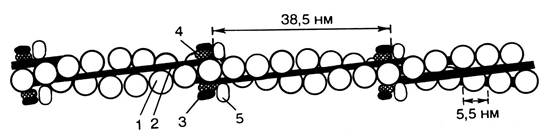
Рис. 2.7. Структура тонкого филамента
1 – актин; 2 – тропомиозин; 3 – тропонин С (кальций связывающий); 4 – тропонин I (ингибирующий); 5 – тропонин Т (тропомиозин-связывающий).
Из белков стромы важная роль отводится коллагену, эластину и ретикулину, по наличию которых судят о прочностных свойствах соединительных тканей.
Коллаген. Фибриллы коллагеновых нитей состоят из субъединиц, называемых тропоколлагеном, в котором R-группы всех аминокислот находятся на внешней стороне молекулы и мало участвуют в стабилизации структуры. Характерным признаком коллагена является высокое содержание пролина и нестандартной аминокислоты – гидроксипролина (рис. 2.8 а), сумма которых составляет около 21 %. На определении 4-гидроксипролина (оксипролина) основаны многие методы количественного анализа коллагена. Нестандартная аминокислота – гидроксилизин (рис. 2.8 б) также может служить средством идентификации коллагенов.
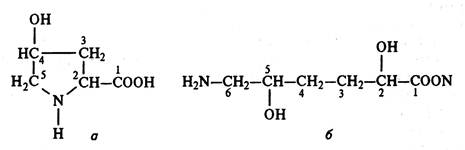
Рис. 2.8. Структурные формулы нестандартных аминокислот, входящих в состав коллагена:
а – гидроксипролин; б – гидроксилизин.
Коллаген способен сильно набухать в водных растворах, при этом масса его увеличивается в 1,5–2 раза. При смещении рН в кислую или щелочную сторону от ИЭТ набухаемость коллагена резко увеличивается, при этом масса белка в состоянии полного набухания может достигнуть от 400 до 1000 % к массе сухого белка. Способность коллагена к набуханию имеет большое значение для мясного, желатинового и кожевенного производств.
Эластин. Это, по существу, многокомпонентная система, представленная сложными белками – гликопротеинами. Подобно коллагену эластин богат глицином и аланином. Тропоэластин отличается от тропоколлагена большим содержанием лизина, но малым – пролина. Суммарное содержание глицина, аланина, валина и пролина в эластине составляет почти 70 %. Из-за малого содержания кислых и основных аминокислот молекула эластина практически неполярна. В водной среде цепи эластина принимают форму глобул. Гидрофобные цепи аминокислот, образующие соответствующие связи, спрятаны внутри молекулы, окруженной водой. В результате свободная энергия системы минимальна. Он очень устойчив: не растворяется в холодной и горячей воде, солевых растворах, разбавленных растворах кислот и щелочей. Даже концентрированная серная кислота оказывает на него слабое воздействие. Он не образует желатин, практически не расщепляется пищеварительными ферментами.
Ретикулин также входит в состав стромы мышечных волокон и соединительных тканей. Подобно коллагену и эластину он является гликопротеином, неполярен, очень устойчив, плохо усваивается организмом.
Таким образом, группа соединительнотканных белков имеет общие свойства и структурные признаки. Именно они используются в исследовательской практике для оценки пищевой ценности сырья и продуктов путем их количественного анализа, например, при определении сорта мяса, а также пищевой ценности по соотношению триптофана и оксипролина.
В соответствии с современной теорией питания роль соединительнотканных белков пересмотрена. Показано, что коллаген и эластин обладают свойствами пищевого волокна, проявляют радиопротекторные свойства, активно стимулируют секреторную и двигательную функции желудка и кишечника, оказывают благоприятное действие на состояние и функцию полезной кишечной микрофлоры. На основе коллагена и других белков соединительной ткани создаются биологически ценные пищевые продукты и добавки с лечебно-профилактическим эффектом.
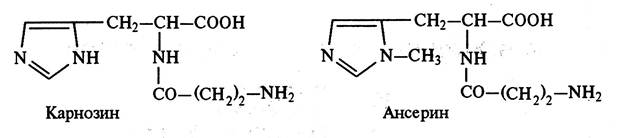
Гистидинсодержащие дипептиды являются специфической составной частью скелетной мускулатуры. Эти вещества выполняют ряд важных функций в процессе обмена веществ и энергии при жизни, участвуя в процессах окислительного фосфорилирования, происходящих в мышцах при образовании макроэргических фосфатных соединений (АТФ и креатинфосфата). Входя в состав мышечной ткани, гистидинсодержащие дипептиды стимулируют секреторную функцию пищеварительных желез. К ним относятся: карнозин – дипептид, состоящий из остатков b-аланина и гистидина, и ансерин – гомолог карнозина, b-аланил-1-метилгистидин (метилированный карнозин).
Кровь – непрозрачная жидкость красного цвета со слабощелочными свойствами (рН 7,3–7,5), специфического запаха и солоноватого вкуса. На долю крови приходится в среднем у крупного рогатого скота 7,5 % живой массы, у свиней – 4,5, у овец – 7 и у птицы – 8 %. Кровь вместе с лимфой и тканевой жидкостью, окружающей клетки, является внутренней средой организма и выполняет ряд весьма важных прижизненных функций (доставка молекулярного кислорода и питательных веществ к клеткам организма, освобождение тканей от углекислоты и продуктов распада). После убоя животных кровь частично остается в капиллярах и потому является неотъемлемой составляющей мяса. В настоящее время кровь приобретает огромное значение и как самостоятельное сырье для производства антианемических продуктов, фракции крови используются для структурирования пищевых систем, придания окраски продуктам, получения эмульсий, обогащения продуктов органическим железом, которое в 4–6 раз быстрее усваивается организмом по сравнению с другими источниками.
Кровь состоит из жидкой части – плазмы и взвешенных в ней форменных элементов. К форменным элементам относятся: эритроциты (красные кровяные тельца), лейкоциты (белые кровяные тельца), тромбоциты (кровяные пластинки, бляшки). В крови разных видов животных массовая доля форменных элементов неодинакова: в среднем у крупного рогатого скота 33 %, у мелкого – 28, у свиней – 43,6 % к массе крови.
Кровь, лишенная форменных элементов (например, центрифугированием с введением антикоагулянтов), представляет собой плазму. На долю растворимых веществ плазмы крови приходится 9–10 % ее массы, из них около 7 % составляют белки, остальная часть состоит из липидных компонентов, азотистых и безазотистых экстрактивных и минеральных веществ.
Плазма крови, из которой выделен белок фибриноген (предшественник фибрина), называется сывороткой.
Массовая доля белков в цельной крови зависит от вида, возраста, упитанности, условий предубойного содержания животных и в среднем составляет: у крупного рогатого скота 17,41 %, баранов – 16,59, свиней – 2,25 %. При этом в среднем 6,8–7,3 % белков находится в плазме, 30,3–32,7 % – в форменных элементах. Основная масса белков крови представлена альбуминами, глобулинами, фибриногеном и гемоглобином.
По аминокислотному составу наиболее полноценным является фибриноген, в структуре которого содержится 3,5 % триптофана, 7,0 % фенилаланина, 2,6 % метионина.
Фибриноген – основной компонент системы свертывания крови. Он нерастворим в воде, но хорошо растворим в разбавленных растворах нейтральных солей и щелочах, осаждается сульфатом магния и хлоридом натрия ранее, чем наступает полное насыщение. Таким образом, фибриноген близок по своим свойствам к глобулинам. Фибриноген быстро усваивается.
Сывороточные альбумин и глобулин также содержат полный набор незаменимых аминокислот, хотя и в меньшем количестве. Особенно мало содержание триптофана в сывороточном альбумине. Гемоглобин нельзя отнести к полноценным белкам, так как в нем отсутствует изолейцин. Однако содержание других незаменимых аминокислот в нем довольно высокое. Поэтому в сочетании с другими белками крови его можно рассматривать как важнейший источник жизненно необходимых аминокислот.
Таким образом, пищевая и биологическая ценность крови тесно связана с наличием природного пигмента – гемоглобина. Это сложный белок, состоящий из окрашенной простетической группы гема и бесцветной белковой части – глобина. Молекула гемоглобина по своей форме приближается к сфере диаметром около 5,5 нм, относительная молекулярная масса 64 500, ИЭТ при рН 5,5. Гемоглобин в кислой и щелочной средах диссоциирует на гем и глобин. Так, если добавить раствор гемоглобина к смеси ацетон – НС1, то глобин осаждается, а гем остается в растворе.
Концентрация гемоглобина в крови зависит от вида животного и количества эритроцитов. Гемоглобин разных животных разнится аминокислотной последовательностью. Гемоглобин выполняет функцию дыхательного белка – переносчика кислорода. При воздействии на гемоглобин окислителей железо гема переходит в трехвалентную форму и образует подобно миоглобину метгемоглобин. Изменение валентности связано с изменением цвета продукта от ярко-алого до коричневого, что имеет прямое технологическое значение. Некоторые фракции белков плазмы крови обладают желирующими свойствами. Сывороточный альбумин способен желировать плазму.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3292; Нарушение авторских прав?; Мы поможем в написании вашей работы!