
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Озон, оксиды азота и ЛОС в фотохимическом смоге
|
|
|
|
Озон в концентрации большей ПДК ядовит из-за вызываемого им раздражения дыхательных путей и его канцерогенных свойств. По своей токсичности озон относится к веществам 1 класса опасности Озон в приземном слое атмосферы зарегистрирован еще в XIX веке, и долгое время считалось, что его концентрация невелика, а основной источник – перенос из стратосферы. Позднее было доказано, что около 80% озона, содержащегося в тропосфере, образуется в ходе фотохимических реакций здесь же.
Для чистого воздуха, не подверженного влиянию антропогенных выбросов, началом фотохимических процессов является фотолиз имеющегося уже здесь озона, под действием фотонов hn ближнего и жесткого ультрафиолета:
а) О3 + hn ® О2 + О(3р) на длинах волн l, 0,32 < l < 0,4 мкм.
б) О3 + hn ® О2 + О(1d) при l < 0,32 мкм,
Реакция б) из-за малого процента коротковолнового волн менее вероятна в тропосфере. Приблизительно 90% образовавшихся в результате реакции возбужденных атомов О(1d) при их взаимодействии с молекулами воздуха переходят в основное состояние О(3р) и расходуются на восстановление озона по реакциям (в, г, д). А оставшиеся 10% атомов О(1d) при нормальных условиях реагируют с водяным паром Н2О по реакции (е)
в) О(1d) + N2 ® О(3р) + N2
г) О(1d) + О2 ® О(3р) + О2
д) О(3р) + О2 + М ® О3 + М, где М любая молекула
е) О(1d) + Н2О ® 2ОН- (гидроксил)
Дальнейшее поведение воздушной системы зависит от концентрации других малых газовых примесей. В отсутствии в атмосфере оксида углерода СО и углеводородов в нижней тропосфере устанавливается фотохимическое равновесие между оксидами азота и озоном (ж,з,и)
ж) NO + O3 ® NO2 + O2
Диоксид азота легко разлагается на длинах волн тропосферной УФ (з)
з) NO2 + hn ® NO + O(3p),
и) O + O2 + M ® O3 +M
Если же в атмосфере присутствуют оксид углерода или углеводороды (что характерно для выхлопных газов автотранспорта), то это равновесие нарушается и поведение системы будет зависеть от концентрации оксидов азота. При концентрации NO< 10 трлн-1 (7´10-6 мг/м3) в тропосфере реализуются циклы, приводящие к деструкции О3, при этом выводятся вещества гидроксильных групп, не восстанавливаются озон и оксиды азота. При концентрации NO > 15 трлн-1 (4) одновременно с образованием озона генерируются OH, HO2, NO, NO2, которые затем вновь вступают в фотохимические реакции в новых циклах, способствуя образованию новых молекул озона. Некоторые «результирующие реакции» фотохимических циклов с углеводородами, увеличивающие количество озона представлены ниже:
к) СО + 2О2 + hn ® CO2 + O3
л) CH4 + 4O2 + hn ® СH2O + H2O + 2O3
Как мы видели, концентрации формальдегида (метаналя) действительно сильно повышены в атмосфере Челябинска в летние месяцы, что свидетельствует присутствии данной реакции в атмосфере города. В ходе фотохимических реакций с альдегидами и кетонами могут образовываться пероксиды и органические кислоты. Например при окисление формальдегида образуется метановая. (муравьиная) кислота НСНО +О® НСООН. Протекание всех реакций зависит от присутствия аэрозольных веществ, которые часто являются катализаторами, абсорбируя газы.
Развитие промышленности и автотранспорта рождает особое загрязнение в городах, в котором озон выступает и как предшественник цепных фотохимических реакций, активизируя на солнечном свету действие многих малых антропогенных примесей, например окислов азота и несгоревших углеводородов выхлопных газов и как их продукт. Наиболее интенсивное образование озона наблюдается в окислительном фотохимическом «тумане» - густой дымке с неприятным запахом (в частности из-за присутствия NO2), содержащей до 1мг/м3 озона. Эта смесь нарушает процесс вегетации, раздражает дыхательные пути и слизистую оболочку глаз, быстро окисляет резину.
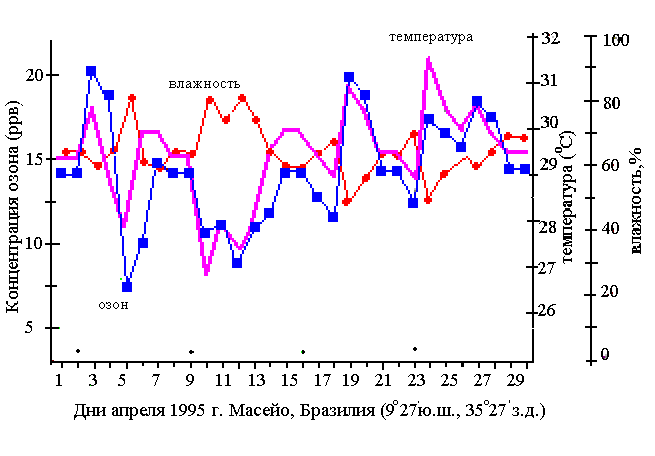
Окислительный смог с участием озона, часто называется «лос-анжелесским». В отличие от восстановительного лондонского смога, где главную роль играет частицы дым и сажи и сернистый газ, и который наблюдается утром при температуре около 00С, фотохимический смог напротив развивается обычно при высоких температурах 24-320С и пониженной влажности. Как и в первом случае, смог лос-анжелесского типа усиливается при наличии инверсии. Коричневый оттенок такой дымки придают диоксид азота и йодистый калий. Влияние температуры и влажности на содержание озона в атмосфере хорошо заметно на рис. 2, где представлен ход влажности, температуры и озона в послеполуденные часы крупном курортном городе северо-востока Бразилии. Заметно, совпадение высоких значений температур и концентраций озона, тогда как влажность при больших концентрациях озона обычно низкая. В данном случае проявляется двойной эффект повышение температуры ведет к понижению влажности с одной стороны, с другой уменьшение влажности препятствует реакциям типа О3+Н2О→Н2О2+О2, выводящей озон.
В фотохимическом смоге, оксиды азота и прежде всего, ядовитый NО2, соединяются при участии ультрафиолетовой солнечной радиации с углеводородами, среди которых наибольшей реакционной способностью обладают олеофины (этилен С2Н4, пропилен С3Н6 и др. гомологи). Органические вещества образуют с оксидами азота пероксилацетилнитрат (ПАН) и другие фотохимические окислители, в том числе пероксибензоилнитрат (ПБН), озон, перекись водорода (H2O2), ацетальдегид, акролеин, диоксид азота.
При конденсации ПАН (обычно достигает 0,1 ррm) выпадает на землю в виде клейкой жидкости, губительно действующей на растительный покров. Все окислители, в первую очередь ПАН и ПБН, сильно раздражают и вызывают воспаление глаз, а в комбинации с озоном раздражают носоглотку, приводят к спазмам грудной клетки, а при высокой концентрации (свыше 3-4 мг/м3) вызывают сильный кашель и ослабляют возможность на чем-либо сосредоточиться. Оценка скорости фотохимических реакций, приводящих к образованию ПАН, ПБН и озона, показывает, что в ряде южных городов страны летом в околополуденные часы (когда велик приток ультрафиолетовой радиации) эти скорости превосходят значения, начиная с которых отмечается образование смога.
 При исследовании условий возникновения опасных условий загрязнения, связанных с образованием фотохимического смога в городе в первую очередь следует определить физические и физико-химические условия протекания процессов:
При исследовании условий возникновения опасных условий загрязнения, связанных с образованием фотохимического смога в городе в первую очередь следует определить физические и физико-химические условия протекания процессов:
1) Спектр и интенсивность солнечной радиации. При меньших длинах волн ультрафиолетовой радиации и больших значениях интенсивности в фотохимические реакции вовлекается всё большее количество веществ. У ряда органических веществ имеются структурные предпосылки для поглощения света с длиной волны более 0,3 микрон. Если эти молекулы не возбуждаются, то остается возможность их атаки агрессивными кислородсодержащими частицами (ОН-, озоном и атомарным кислородом).
2) Параметры атмосферного воздуха. Высокая температура является катализатором фотохимических реакций, обеспечивает присутствие паров ряда веществ с относительно высокой температурой кипения. При высокой влажности происходит обводнение аэрозоли, образование капель и выводя ряд веществ из фотохимических реакций. Отсутствие ветра и наличие инверсионных слоёв способствуют накоплению примесей.
3) Характер загрязнения: процессы перехода легких ЛОС в более тяжелые фракции управляется концентрациями фотохимически-активных оксидов азота, оксида углерода и сернистого газа, наличие твердых аэрозолей содержащих металлы является катализатором ряда реакций.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1656; Нарушение авторских прав?; Мы поможем в написании вашей работы!