
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз растворов
|
|
|
|
При рассмотрении электролиза водных растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы, являющиеся продуктами диссоциации воды — Н+ и ОН-. В электрическом поле ионы водорода перемещаются к катоду, а ионы ОН- — к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и гидроксид-ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего, будет зависеть от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем — катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН = 7) имеет значение  = - 0,059 рН = - 0,413 В.
= - 0,059 рН = - 0,413 В.
Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем —0,41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Наконец, если потенциал металла близок к значению —0,41 В (металлы средней части ряда — Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
Н2О + 2 = Н2 + 2ОН-
= Н2 + 2ОН-
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Активным (растворимым) называется анод, материал которого может окисляться в ходе электролиза. Инертным (нерастворимым) называется анод, материал которого не претерпевает окисления в ходе электролиза. К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, уголь, платину, иридий, двуокись свинца, магнетит, композиции на основе тантала и титана, оксид рутения и другие вещества, имеющие положительные значения равновесных электродных потенциалов. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например, никель и железо в щелочном растворе, свинец в H2SO4, титан, тантал, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтороводорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид:
4ОН- = О2 + 2Н2О + 4 ,
,
в кислой или нейтральной:
2Н2О = О2 + 4Н+ + 4 .
.
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона 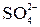 равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В).
равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В).
2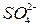 =
=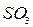 + 2
+ 2  +
+ 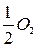 , (
, ( 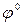 = 2,01 В).
= 2,01 В).
Стандартный потенциал окисления иона F- имеет еще большее значение (2,866В).
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI, HBr, HC1 и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе НС1 и ее солей противоречит взаимному положению систем
С12 + 2 = 2Сl- (
= 2Сl- ( 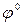 = 1,358В),
= 1,358В),
О2 + 4Н+ + 4 = 2Н2О (
= 2Н2О (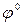 = 1,229В)
= 1,229В)
в ряду стандартных электродных потенциалов. В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Для выбора наиболее вероятного процесса на катоде и аноде при электролизе растворов с использованием инертного (нерастворимого) анода используют следующие правила:
1. На аноде образуются:
а) при электролизе растворов, содержащих анионы F–, 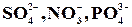 , OH– – газообразный O2;
, OH– – газообразный O2;
б) при окислении анионов Сl–, Вr–, I– – соответственно газообразные Сl2, Вr2, I2.
2. На катоде образуются:
а) при электролизе растворов, содержащих ионы, расположенные в ряду напряжений левее Аl3+, – газообразный Н2;
б) если ионы расположены в ряду напряжений правее водорода – чистые металлы;
в) если ионы расположены в ряду напряжений между Аl3+ и H+, то на катоде могут протекать конкурирующие процессы – восстановление как чистых металлов, так и газообразного водорода;
г) если водный раствор содержит катионы различных металлов, то их восстановление протекает в порядке уменьшения величины стандартного электродного потенциала (справа налево по ряду напряжений металлов).
В случае использования активного (растворимого) анода (из меди, серебра, цинка, никеля, кадмия) анод сам подвергается окислению (растворяется) и на катоде кроме катионов металла соли и ионов водорода восстанавливаются катионы металла, полученные при растворении анода.
Восстановительные свойства металлов удобно сравнивать, используя электрохимический ряд напряжений, в который включен и водород. Восстановительная способность элементов в этом ряду уменьшается слева направо, в этом же направлении увеличивается окислительная способность соответствующих катионов.
Как уже сказано, зависимость электродного потенциала от природы веществ - участников электродного процесса учитывается величиной 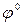 . В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных потенциалов. уравнения важнейших электродных процессов и соответствующие электродные потенциалы приведены в порядке возрастания величин
. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных потенциалов. уравнения важнейших электродных процессов и соответствующие электродные потенциалы приведены в порядке возрастания величин 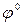 в ряду стандартных электродных потенциалов, который соответствует ряду активности металлов.
в ряду стандартных электродных потенциалов, который соответствует ряду активности металлов.
| Li K Ba Ca Na Mg Al Ti Zr Mn | Zn Cr Fe Cd Ni Mo Sn Pb | H Sb Bi Cu Ag Hg Pt Au |
окислительные способности элементов возрастают

| ||
 восстановительные способности элементов возрастают восстановительные способности элементов возрастают
| ||
Трудно разряжаемые металлы (активные «неблагородные»металлы)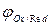 отрицательнее -1,0 В отрицательнее -1,0 В
| Менее активные металлы
-1,0 B<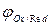 < 0,0 B < 0,0 B
| Легко разряжаемые металлы
(Благородные металлы)
 >0,0 B >0,0 B
|
| Продукты электролиза в водных растворах | ||
| Только водород | Металлы и водород | Только металлы |
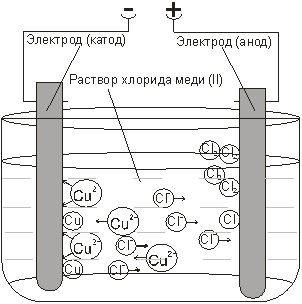
Рассмотрим несколько типичных случаев электролиза водных растворов. Рассмотрим электролиз раствора хлорида меди (II). Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. (Рис.1)
|
| Рис. 1. Электролиз раствора хлорида меди(II) |
пример 1. схема электролиза водного раствора хлорида меди с использованием инертных электродов.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | CuCl2 Cu2+ + 2Cl- Cu2+ + 2Cl-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | ионы меди в растворе восстанавливаются. На аноде в водном растворе ионы хлора окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Cu2+ + 2 = Cu0
А+: 2Cl- - 2 = Cu0
А+: 2Cl- - 2 = Cl20 = Cl20
|
| 4. | составить уравнение электролиза водного раствора соли | CuCl2 Cu0 + Cl20 Cu0 + Cl20
|
пример 2. Схема электролиза водного раствора сульфата меди(II) с использованием инертных электродов.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | CuSO4 Cu2+ + SO42- Cu2+ + SO42-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | ионы меди в растворе восстанавливаются. На аноде в водном растворе сульфат-ионы не окисляются, поэтому окисляется вода. |
| 3. | составить схемы процессов восстановления и окисления | К-: Cu2+ + 2 = Cu0
А+ : Н2О - 4 = Cu0
А+ : Н2О - 4 = 4Н+ + О2 = 4Н+ + О2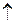
|
| 4. | составить уравнение электролиза водного раствора соли | 2CuSO4+2Н2О 2Cu0 2Cu0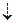 +О20 +О20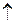 + 2Н2SO4 + 2Н2SO4
|
пример 3. схема электролиза водного раствора хлорида натрия с использованием инертных электродов.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | NaCl Na+ + Cl- Na+ + Cl-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | ионы натрия в растворе не восстанавливаются, поэтому идет восстановление воды. ионы хлора окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Н2О + 4 = Н2 + 2ОН-
А+: 2Cl- - 2 = Н2 + 2ОН-
А+: 2Cl- - 2 = Cl20 = Cl20
|
| 4. | составить уравнение электролиза водного раствора соли | NaCl+Н2О Н2 Н2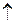 +Cl20 +Cl20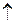 +NaОН +NaОН
|
пример 4. схема электролиза водного раствора хлорида цинка с использованием инертных электродов.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | ZnCl2 Zn2+ + 2Cl-
Н2О Zn2+ + 2Cl-
Н2О Н+ +2ОН- Н+ +2ОН-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | ионы цинка в растворе восстанавливаются (основной процесс) совместно с восстановлением протонами водорода (побочный процесс). ионы хлора окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Zn2+ + 2  Zn0 (основной процесс)
К-: 2Н+ - 2 Zn0 (основной процесс)
К-: 2Н+ - 2  Н2 Н2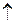 (побочный процесс)
А+: 2Cl- - 2 (побочный процесс)
А+: 2Cl- - 2 = Cl20 = Cl20
|
| 4. | составить уравнение электролиза водного раствора соли | ZnCl2+Н2О Zn0 + Н2 Zn0 + Н2 +Cl20 +Cl20
|
пример 5. Электролиз водного раствора щелочи (гидроксида натрия) с использованием инертных электродов.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | NaОН Na+ +ОН- Na+ +ОН-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | Ионы натрия в растворе не восстанавливаются, поэтому идет восстановление воды. На аноде окисляются гидроксид-ионы. |
| 3. | составить схемы процессов восстановления и окисления | К-: Н2О + 4 = Н2 = Н2 + 2ОН-
А+: 4ОН- - 4 + 2ОН-
А+: 4ОН- - 4 = О2 = О2 + 2Н2О + 2Н2О
|
| 4. | составить уравнение электролиза водного раствора соли | Н2О Н2 Н2 +О20 +О20 ,т.е электролиз раствора щелочи сводится к электролизу воды ,т.е электролиз раствора щелочи сводится к электролизу воды
|
пример 6. Схема электролиза водного раствора сульфата меди(II) с использованием растворимого медного электрода.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | CuSO4 Cu2+ + SO42- Cu2+ + SO42-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | Ионы меди в растворе восстанавливаются. На аноде в водном растворе окисляется металлический медный электрод, сульфат-ионы не окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Cu2+ + 2 = Cu0
А+ : Cu0 - 2 = Cu0
А+ : Cu0 - 2 = Cu2+ = Cu2+
|
пример 7. Электролиз раствора NiSO4 с никелевым анодом (растворимым). Стандартный потенциал никеля (-0,25 В) несколько больше, чем –0,41 В; поэтому при электролизе нейтрального раствора NiSO4 на катоде в основном происходит разряд ионов Ni2+ и выделение металла. На аноде происходит противоположный процесс—окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более—потенциала окисления иона SO42-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | NiSO4 Ni2+ + SO42- Ni2+ + SO42-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | Ионы никеля в растворе восстанавливаются. На аноде в водном растворе окисляется металлический никелевый электрод, сульфат-ионы не окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Ni2+ + 2 = Ni0
А+ : Ni0 - 2 = Ni0
А+ : Ni0 - 2 = Ni2+ = Ni2+
|
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2430; Нарушение авторских прав?; Мы поможем в написании вашей работы!