
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон Фарадея
|
|
|
|
Законы электролиза
Масса вещества, выделившегося на электроде при прохождении по раствору электролита электрического тока, прямо пропорциональна количеству пропущенного электричества.
m=k·Q
где m- масса выделившегося вещества, k – коэффициент пропорциональности, называемый электрохимической эквивалентной массой, Q – количество электричества, выраженное в единицах заряда (Кл = А·ч, либо в А·ч).
Поскольку количества электричества Q это произведение силы электрического тока (А) на время t затраченного на электролиз (с), т.е. 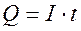 , то первый закон Фарадея можно представить в виде:
, то первый закон Фарадея можно представить в виде:

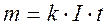
Количественной мерой электрического заряда является единица «Фарадей». Фарадей – это заряд, который несет на себе один моль электронов или один моль однозарядных ионов,
1F = 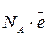 = 6.02·1023·1.6·10-19
= 6.02·1023·1.6·10-19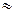 96500 Кл = 26,8 А·ч
96500 Кл = 26,8 А·ч
1F=96500 Кл = 26,8 А·ч
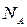 - число Авогадро,
- число Авогадро,  - заряд электрона.
- заряд электрона.
Если через раствор пропустить 1 Фарадей электричества (96500 Кл), то на электроде выделится 1 моль-эквивалент вещества.
2. второй закон Фарадея:
Согласно второму закону Фарадея, при определённом количестве прошедшего электричества отношения масс прореагировавших веществ равно отношению их химических эквивалентов.
Химический эквивалент элемента, равен отношению части массы элемента, которая присоединяет или замещает в химических соединениях одну атомную массу водорода или половину атомной массы кислорода, к 1/12 массы атома С12.
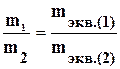 ,
,
где m1 – масса вещества (1) образовавшегося или подвергнутого превращению вещества: mэкв1.- его эквивалентная масса; m2 – масса вещества (2) образовавшегося, mэкв2.- его эквивалентная масса;
3. Объединенный закон Фарадея:
Масса электролита, подвергшаяся превращению при электролизе, а также масса образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через электролит, и эквивалентным массам соответствующих веществ.
Этот закон выражается следующим уравнением: 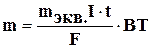
где m – масса образовавшегося или подвергнутого превращению вещества: mэкв.- его эквивалентная масса; I – сила тока, t - время в секундах, F = 96500 кл – число Фарадея, (или t - время в часах, то F = 26,8 А·ч); ВТ – выход по току.
Или при вычислении объемов выделившихся газов: 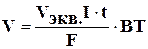
V – объем выделившегося газа (л);Vэкв.- эквивалентный объем (л/моль). Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2375; Нарушение авторских прав?; Мы поможем в написании вашей работы!