
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
Лекция 14
Применение электролиза
Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов.
Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда - концентрат подвергается обработке определенными реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор направляют на электролиз. Металл выделяется на катоде и в большинстве случаев характеризуется высокой чистотой. Этим методом получают главным образом цинк, медь и кадмий.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Электролитическому рафинированию металлы подвергают для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению - переходит в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя компактный осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются. К числу металлов, получаемых электролизом расплавленных сред относятся алюминий, магний, цирконий, титан, уран, бериллий и ряд других металлов.
Электролиз применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
Основные виды коррозии. Классификация коррозионных процессов. Химическая коррозия. Электрохимическая коррозия.
Коррозия — это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия — самопроизвольный процесс и соответственно протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию—в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах; б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Рассмотрим химическую коррозию в газах (газовая коррозия), в частности коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде
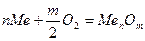
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т. е. при условии, если энергия Гиббса ниже нуля: 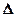 G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
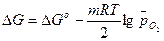 ,
,
где 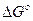 - стандартная энергия гиббса реакции;
- стандартная энергия гиббса реакции; 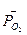 -относительное парциальное давление кислорода (р /100).
-относительное парциальное давление кислорода (р /100).
большинство металлов в атмосфере кислорода могут подвергаться химической коррозии. Однако термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах — в водных растворах солей, кислот, щелочей, в морской воде; б) в атмосфере любого влажного газа; в) в почве.
процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты. Окислители играют двойную роль в коррозионных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой (для металла, способного к пассивации) - вызвать пассивацию металла и резкое торможение коррозии. Обычно это наблюдается на металлах, способных пассивироваться, таких, как хром, алюминий, титан, цирконий, никель, тантал и др. Пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса.
Механизм электрохимической коррозии. Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металлов
Me0 - ne-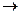 Me n+
Me n+
и катодное восстановление окислителя (Ox)
Ox + ne- 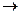 Red
Red
Наиболее часто при коррозии наблюдается восстановление молекул кислорода:
а) в нейтральной или щелочной среде: 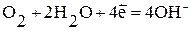 ;
;
б)в кислой среде: 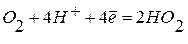 ;
;
и выделение водорода в кислой среде: 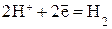 ,
,
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозия во влажном воздухе при комнатной температуре - деполяризатором является кислород (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией).
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворе. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный стандартный электродный потенциал (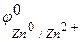 =-0,763 В), чем кадмий (
=-0,763 В), чем кадмий (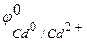 = -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
= -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
(А) Zn/ среда / Cd (К)
| Анодный процесс: | А: 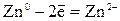
|
| Катодный процесс: а) в кислой среде б) в нейтральной среде | К: 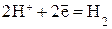 К:
К: 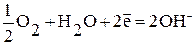
|
а) в кислой среде образуется соль цинка и газообразный водород
б) Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(ОН)2.
ЭДС системы равна разности потенциалов окислителя и восстановителя:
Е. = 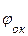 -
- 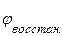 =
= 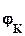 -
- 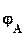 ,
,
то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла: 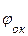 >
>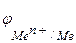 . Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса:
. Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса: 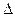 G = - E∙n∙F,
G = - E∙n∙F,
где Е - ЭДС (Е) элемента в [В]; n – число электронов, принимающих участие в электродном процессе, F = 96500 Кл/моль=96500 Дж/моль В – число Фарадея.
Если ЭДС элемента имеет положительное значение (Е>0), то коррозия возможна, т.к. 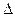 G < 0, а процесс протекает самопроизвольно.
G < 0, а процесс протекает самопроизвольно.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 998; Нарушение авторских прав?; Мы поможем в написании вашей работы!