КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вращение молекулы
|
|
|
|
Введение.
Микроволновая спектроскопия является одним их трех главных методов исследования геометрии молекул. А геометрическое строение свободных молекул имеет особое значение для химии, так как составляет основу теории химического строения молекул.
В этом курсе мы остановимся только на методе микроволновой спектроскопии хотя бы потому, что этим методом в свое время занимались в ИНФОУ Кроме того, применение этих методов ограничивается исследованием только сравнительно малых молекул, поэтому для общего представления об их возможностях достаточно будет ознакомления с одним из них. Два других метода оставляются для самостоятельного ознакомления заинтересованных лиц. Один из них основан на получении чисто вращательных спектров комбинационного рассеивания и менее распространен, чем микроволновая спектроскопия, другой метод – метод газовой электронографии – относится к дифракционным методам.
|
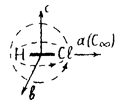
Вращение молекулы можно разложить по трем взаимно перпендикулярнвм координатам (осям а, b и с), как это показано на рисунке:
Моменты инерции І:
Іа – вокруг связи (ось а), Ib – в плоскости листа (ось b), Іс – перпендикулярно плоскости бумаги (ось с).
9.2.2. Типы вращающихся молекул.
9.2.2.1. Линейные молекулы H-Cl, O=C=S (Ia = 0, Ib = Ic).
9.2.2.2. Симметричный волчок СН3-F: Ia ¹ 0, Ib = Ic ¹ Ia
9.2.2.3. Сферический волчок: СН4 (Ia = Ib = Ic).



 9.2.2.4. Асимметричный волчок: О Н Н
9.2.2.4. Асимметричный волчок: О Н Н

 (Ia ¹ Ib ¹ Ic). Н Н, С = С
(Ia ¹ Ib ¹ Ic). Н Н, С = С
Н Cl
9.3. Двухатомная молекула (Ia = 0, Ib = Ic).
3.1. Модель двухатомного жесткого ротатора.
Это наиболее простая модель, в которой длина связи не меняется при вращении, а атомы не совершают колебательных движений. Параметры этой модели:
m1 O m2 ro = r1 + r2 , O – центр тяжести, где в условиях равнове-






 сия m1r1 = m2r2, момент инерции I = m1r12 + m2r22 =
сия m1r1 = m2r2, момент инерции I = m1r12 + m2r22 =

 = m1r1r2 + m2r2r1 = r1r2(m1 + m2). Отсюда вытекает:
= m1r1r2 + m2r2r1 = r1r2(m1 + m2). Отсюда вытекает:
r1 r2 r1 = m2ro /(m1 + m2), r2 = m1ro /(m1 + m2),
а I = m1m2ro2 /(m1 + m2) = Mro2, где 1/M = 1/m1 + 1/m2. В данном случае М – приведенная масса.
Решение уравнения Шредингера обусловлено типом молекул: и зависит от соотношения Ia, Ib и Ic. Для вращательной энергии двухатомной молекулы решение имеет следующий вид:
Ej (Дж) = j(j+1)h2/8π2Ib,
где Ib = I, а вращательное квантовое число J принимает значения ряда положительных целых чисел: 0, 1, 2, 3, 4... Тогда уровни вращательной энергии, выраженные в виде волновых чисел в зависимости от J принимают следующие значения:
 Ej /hC = Bj(j+1), j 0 1 2 3 4 5 6
Ej /hC = Bj(j+1), j 0 1 2 3 4 5 6
где B = h/8π2IbC Ej /hC 0 2Β 6Β 12Β 20Β 30Β 42Β
 νизлуч (см-1) 2Β 4Β 6Β 8Β 10Β 12Β
νизлуч (см-1) 2Β 4Β 6Β 8Β 10Β 12Β
Здесь В – вращательная постоянная.
9.3.2. Правила отбора.
9.3.2.1. По дипольному моменту молекулы μ (μ = le).
Для всех типов вращающихся молекул запрещены переходы, когда μ = 0.
Другими словами, излучению не с чем взаимодействовать, если молекулы не полярные, для которых вращательные спектры не наблюдаются
9.3.2.2. По вращательному квантовому числу.
Разрешены переходы, если Δj = +1.


 Разрешенные переходы: 0 1, 1 2, 2 3 и т.д.
Разрешенные переходы: 0 1, 1 2, 2 3 и т.д.
|
Таким образом, вращательная постоянная В находится из спектра как расстояние между двумя соседними линиями, а уже из нее вычисляют ro.
9.3.3. Интенсивность полос спектра.
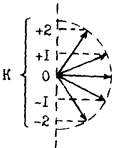
9.3.3.1. Вырождение уровней энергии.
Число вырожденных уровней Nj = 2j + 1.
|
j = 2 j 0 1 2 3 4 Р – момент количества вращения
Nj 1 3 5 7 9 Р = Ιω = 2πνврІ.
K – квантовое число момента
количества вращения вокруг оси
вращения или оси волчка.
 выбранное направление, может стать реальным в
выбранное направление, может стать реальным в
случае асимметричного волчка или опыта Штарка.
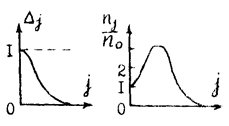
9.3.3.2. Распределение молекул по вращательным уровням.
Заселенность молекул по каждому вращательному энергетическому уровню определяется распределением Максвела – Больцмана:
Δj = exp(-BhCj(j+1)/ kbT), где kb – постоянная Больцмана.
|
9.3.4. Нежесткий ротатор (учет колебания и вращения).
Решение уравнения Шредингера для вращения гармонического осцилятора:
Ej/hC = Bj(j+1) – Dj2(j+1)2,
где постоянная центробежного растяжения D определяется равенством:
D= h3/32π4I2r2kC (см-1) = 16B3π2MC2/k.
Здесь k – силовая постоянная связи в свою очередь определяется уравнением:



 k = 4π2C2M ν2кол. Тогда D = 4B3/ ν2кол, где νкол – волновое число колебания связи (см-1). Поскольку D << B, то величиной D можно обычно пренебречь при j < 10.
k = 4π2C2M ν2кол. Тогда D = 4B3/ ν2кол, где νкол – волновое число колебания связи (см-1). Поскольку D << B, то величиной D можно обычно пренебречь при j < 10.
Для ангармонического осцилятора в уравнение для энергии вводятся постоянные ангармоничности, коими в большинстве случаев также можно пренебречь.
 Таким образом, для реальной двухатомной молекулы получают информацию в виде волнового числа νj(обр) = (Еj+1 – Ej) /hC = 2B(j+1) – 4D(j+1)3. По любым трем смежным линиям спектра определяют j, B и D. Из В вычисляют значения ro, а з D – величину νкол.
Таким образом, для реальной двухатомной молекулы получают информацию в виде волнового числа νj(обр) = (Еj+1 – Ej) /hC = 2B(j+1) – 4D(j+1)3. По любым трем смежным линиям спектра определяют j, B и D. Из В вычисляют значения ro, а з D – величину νкол.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 772; Нарушение авторских прав?; Мы поможем в написании вашей работы!