
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ №6
|
|
|
|
ЭНТРОПИЯ. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ
Таблица 1
|
1. Поясним смысл термодинамической вероятности на примере газа, состоящего из одинаковых молекул. В классической физике считается, что принципиально можно проследить за движением каждой молекулы. Поэтому пронумеруем их. Вследствие соударений, молекулы обладают различными кинетическими энергиями. Состояние, при котором в каждом месте объёма газа находится молекула с определённым номером и значением энергии, называют микросостоянием. Предположим, что в газе (в термодинамической системе) в результате теплового движения две молекулы поменялись местами. Это приводит к изменению микросостояния системы. Однако такой переход не меняет состояния термодинамической системы, поскольку переход указанных молекул не изменяет ни плотности газа, ни суммарной кинетической энергии молекул системы. Число молекул в газе велико. Поэтому и число переходов молекул также велико. При таких переходах молекул состояние газа не изменяется, в то время как микросостояния этого газа изменяются, так как изменяются порядковые номера молекул в каждом месте объёма газа. Таким образом, одному состоянию термодинамической системы соответствует большое число микросостояний, которые отличаются друг от друга перестановками молекул. Это число микросостояний и называют термодинамической вероятностью. Итак, термодинамическая вероятность системы — это число равновероятных микросостояний, каждое из которых реализует данное состояние системы.
Определение термодинамической вероятности системы представляет собой труднейшую задачу статистической физики, порой и неразрешимую. Поэтому рассмотрим простейший случай, когда удаётся её рассчитать.
3. Пусть в сосуде находятся четыре молекулы. Чтобы молекулы можно было различить, пронумеруем их от 1 до 4. Мысленно разделим сосуд на две равные части А и В. Вследствие движения молекул, возможны следующие их распределения между этими частями (табл. 1). В части А (или В) молекул нет, а все они собираются в части В (или А). Такое состояние реализуется лишь одним микросостоянием. Поэтому термодинамическая вероятность состояний 1 и 5 равна 1. Состояния 2 и 4 каждое реализуется четырьмя микросостояниями, а состояние 3 — шестью. Следовательно, их термодинамическая вероятность равна 4 и 6, соответственно.
ЭНТРОПИЯ. ФОРМУЛА БОЛЬЦМАНА
Энтропия S термодинамической системы определяется по формуле:
S = k· ln G, (1)
где k — постоянная Больцмана, G — термодинамическая вероятность состояния системы. Из этой формулы вытекает физический смысл энтропии: энтропия есть мера беспорядка системы (или мера хаоса). Действительно, как было показано, термодинамическая вероятность G характеризует беспорядок, а энтропия зависит от G. Эта формула была получена Больцманом и носит его имя.
Каждое состояние любой термодинамической системы имеет определённое значение энтропии S. Следовательно, энтропию можно рассматривать как определённый параметр системы, наряду с температурой, давлением и объёмом.
Используя формулу (1), находим изменение энтропии D S при различных процессах, т.е. при переходе системы из состояния с энтропией S 1 в состояние с S 2:
 (2)
(2)
где G 1 и G 2 — термодинамическая вероятность системы в начальном и конечном состояниях.
Формула Больцмана даёт взаимосвязь энтропии S с термодинамической вероятностью состояния и определяет физический смысл этой величины. Однако для практики термодинамических расчётов она в большинстве случаев непригодна, так как задача вычисления термодинамической вероятности состояния ввиду огромного числа молекул часто не решается вообще. Существуют соотношения, которые связывают энтропию с другими, легко определяемыми параметрами состояния системы. Элементарное изменение dS энтропии системы находится по формуле:
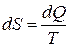 . (3)
. (3)
dQ — элементарное количество теплоты, сообщённое системе, Т — температура, при которой происходит передача теплоты.
Изменение энтропии D S находят по формуле:
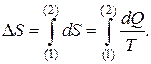 (4)
(4)
Для изотермического процесса получаем:
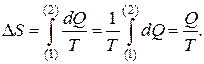 (5)
(5)
Здесь Q — количество теплоты, полученное или отданное системой.
ИЗМЕНЕНИЕ ЭНТРОПИИ ПРИ НЕКОТОРЫХ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССАХ
1. Равновесные и неравновесные, обратимые и необратимые процессы. Состояние термодинамической системы, при котором все её параметры состояния сколь угодно долго остаются неизменными при неизменных внешних условиях, называется равновесным. Переход термодинамической системы из одного состояния в другое называют термодинамическим процессом (или процессом). При этом изменяется хотя бы один из параметров состояния. Процесс, состоящий из ряда последовательных равновесных состояний, называется равновесным. Все процессы в термодинамике можно разделить на два вида: обратимые и необратимые. Обратимым называют такой процесс, который можно провести в прямом и обратном направлениях. При этом при обратном процессе термодинамическая система проходит через те же состояния и возвращается в исходное состояние, не изменив ничего в окружающей систему среде. Процессы, которые не удовлетворяют условиям обратимого процесса, называются необратимыми. Такими являются все реально происходящие процессы.
2. Теплообмен. Рассмотрим замкнутую термодинамическую систему, состоящую из двух тел. (Замкнутой называют термодинамическую систему, которая не получает извне и не отдаёт окружающей среде энергию). Обозначим температуры этих тел через T 1 и T 2. При этом считаем T 1 > T 2. Предположим, что от нагретого тела к холодному переходит столь малое количество теплоты dQ, что изменением температуры тел можно пренебречь. Этот переход приводит к изменению энтропии системы. Очевидно, что изменение энтропии dS системы равно сумме изменения энтропии dS 1 первого тела и dS 2 второго, т.е. dS = dS 1 + dS 2. Тогда, согласно (3), dS 2 = dQ/T 2 и dS 1 = – dQ/T 1. Знак минус стоит потому, что первое тело отдаёт энергию. Поэтому
 (6)
(6)
Поскольку T 1 > T 2 и dQ положительное, то dS > 0, т.е. энтропия системы возрастает. Итак, энтропия замкнутой термодинамической системы возрастает в результате теплообмена между телами, входящими в неё. Физический смысл роста энтропии при теплообмене с точки зрения порядка в системе заключается в следующем. В случае двух тел с разными температурами имеется "порядок" в энергиях молекул: у одного тела энергия молекул больше, у другого — меньше. После теплообмена этот "порядок" пропал — быстрые и медленные молекулы распределились равномерно, что означает больший "энергетический хаос". Это и приводит к росту энтропии.
3. Адиабатический процесс. Согласно определению адиабатического процесса, термодинамическая система изолирована от окружающей среды и поэтому не получает извне количество теплоты, т.е. dQ = 0. Поэтому из (5) следует, что 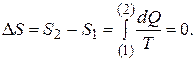 Следовательно, и S 2 = S 1. Однако этот вывод справедлив лишь для случая равновесной системы. Если же в начальный момент система неравновесная, то энтропия будет возрастать. Действительно, диффузия газов или теплообмен между телами, заключёнными в адиабатическую (теплоизоляционную) оболочку, приводит к возрастанию энтропии. Таким образом, для адиабатического процесса D S ³ 0, где знак неравенства справедлив для необратимого процесса, а равенства — для обратимого. Таким образом, при адиабатическом процессе энтропия термодинамической системы либо остаётся постоянной, либо возрастает.
Следовательно, и S 2 = S 1. Однако этот вывод справедлив лишь для случая равновесной системы. Если же в начальный момент система неравновесная, то энтропия будет возрастать. Действительно, диффузия газов или теплообмен между телами, заключёнными в адиабатическую (теплоизоляционную) оболочку, приводит к возрастанию энтропии. Таким образом, для адиабатического процесса D S ³ 0, где знак неравенства справедлив для необратимого процесса, а равенства — для обратимого. Таким образом, при адиабатическом процессе энтропия термодинамической системы либо остаётся постоянной, либо возрастает.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Из рассмотренных примеров следует вывод, что при протекании самопроизвольных термодинамических процессов энтропия системы возрастает либо остаётся постоянной. Этот факт нашёл отражение в виде наиболее общей формулировки второго закона термодинамики: при любых процессах, происходящих в замкнутой термодинамической системе, её энтропия не убывает, т.е.
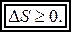 (7)
(7)
Здесь D S — изменение энтропии системы, знак неравенства относится к необратимым процессам, а равенства — к обратимым. Из второго закона следует, что в замкнутой термодинамической системе самопроизвольно протекают лишь процессы, приводящие к возрастанию энтропии. Существуют и другие формулировки второго закона термодинамики, которые непосредственно следуют из основной формулировки второго закона. Рассмотрим одну из них.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 301; Нарушение авторских прав?; Мы поможем в написании вашей работы!