
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аминокислоты с положительно заряженными полярными R-группами
|
|
|
|
Аминокислоты с отрицательно заряженными полярными R-группами
К этому классу относятся две дикарбоновые кислоты – аспарагиновая и глютаминовая, имеющие при РН 7 суммарный отрицательный заряд.
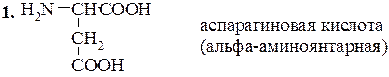

В этот класс входят две основные аминокислоты – лизин и аргинин, и слабоосновная кислота – гистидин, несущие при рН 7 суммарный положительный заряд. Структура их такова:
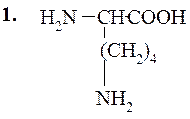
Лизин (α,e-диаминокапроновая кислота)
Аргинин (α-амино-d-гуанидинвалериановая кислота) 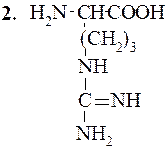
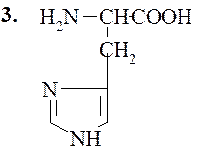
Гистидин (α-амино-β-имидозолилпропионовая кислота)
Индивидуальный белок не обязательно содержит все перечисленные аминокислоты, а аминокислоты, которые постоянно входят в состав различных белков, содержатся в них в неравных количествах.
Помимо аминокислот, постоянно встречающихся в белках, имеются аминокислоты, присутствующие лишь в отдельных белках. Так, в состав коллагена и желатина входят аминокислоты гидроксилизин, а в состав тиреоглобулина – аминокислота тироксин, обладающая гормональными свойствами.
Встречающиеся в белках редкие аминокислоты представляют собой производные обычных аминокислот и в генетическом отношении отличаются тем, что не кодируются кодонами.
Кроме приведенных аминокислот, входящих в состав белков, из растений, животных и микроорганизмов выделено около 200 непротеиногенных аминокислот, которые существуют в свободной форме, либо в связанном состоянии. В большинстве своем они являются производными альфа - аминокислот, входящих в состав белков, могут быть α (альфа), λ (гамма) и δ (дельта) - аминокислотами.
После того как было выяснено, что аминокислоты, имеющие разнообразные функциональные группы, являются структурными элементами (мономерами), из которых построены белковые вещества, встал вопрос о способе связи отдельных аминокислот между собой в белковой молекуле.
На основании многочисленных исследований в настоящее время признано, что в нативных белках имеются следующие виды связей:
- ковалентные связи в виде пептидных и дисульфидных связей;
- нековалентные связи в виде водородных связей, ионных связей и неполярных связей.
Пептидная (амидная) связь является основной сильной ковалентной связью, соединяющей аминокислоты в составе белковой молекулы.
Пептидные связи образуются только между альфа-карбоксильными группами и альфа-аминогруппами соседних аминокислот. Теоретически пептидная связь возникает при реакции двух аминокислот с выделением воды.
Структуры, возникающие в результате образования пептидных связей между остатками аминокислот, называются пептидами. Пептид, содержащий два аминокислотных остатка, называется дипептидом; содержащий три остатка – трипептидом и т.д. Соединения, состоящие из многих аминокислотных остатков, называются полипептидами.
В наименовании пептидов первым указывается остаток аминокислоты, несущий свободную альфа-аминогруппу. Если аминокислота вступает в пептидную связь своей карбоксильной группой, то она рассматривается как ацильный радикал и соответственно приобретает окончание «- ил». Концевая аминокислота, содержащая свободную карбоксильную группу, не меняет своего названия.
С электронной точки зрения для пептидной связи можно написать две возможные формулы: когда пептидная связь простая и когда двойная.
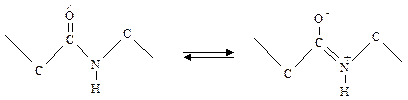
В действительности распределение электронов не соответствует ни одной из этих формул, а лежит между ними за счет сопряжения электронов. Это явление обозначают как мезомерию или резонанс, а обе формулы – как мезомерные пограничные структуры. Часто для мезомерной системы употребляют упрощенную манеру написания:
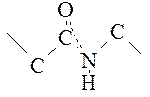
При мезомерии в силу сопряжения электронов у кислородного атома карбонильной группы имеется избыток электронов, а у атома азота иминогруппы – недостаток, в силу чего карбонильная группа приобретает повышенную электроотрицательность, а иминогруппа – повышенную электроположительность.
Благодаря мезомерии связь между С- и N-атомами пептидной связи является не чисто простой (одинарной) и не чисто двойной связью, а по своим свойствам находится между этими обоими типами связи. Частично двойной характер пептидной связи можно доказать, исходя из расстояния между атомами. При простой связи расстояние между С- и N-атомами равно 0,147 нм, при пептидных связях оно укорочено до 0,132 нм. По Полингу резонанс ведет к увеличению стабильности, что объясняет относительную прочность пептидных связей. Это обстоятельство имеет два важных последствия:
1. Иминогруппа (НN=) пептидной связи не обладает заметно выраженной способностью отщеплять или присоединять протон при рН от 0 до 14;
2. Свободное вращение атомов вокруг С--N-связи отсутствует, поэтому атомы пептидных групп лежат в одной плоскости, что получило названия копланарность. При этом возможны лишь две конфигурации (цис- и транс—форма), из которых только транс-форма встречается в естественных пептидах и белках.

транс-форма цис-форма
Все это имеет чрезвычайно важное значение для процесса формирования трехмерной структуры полипептидных цепей.
Так как при образовании пептидных связей в протеинах участвуют только альфа-аминогруппы и смежные альфа-карбоксильные группы, каждая отдельная аминокислота вносит в полипептидную цепочку одинаковый структурный элемент в виде
- HN – CH – COO-
|
Эти элементы образуют «хребет» полипептидной цепи. Отсюда «хребет» или «основной скелет» пептидной цепи характеризуется абсолютным единообразием строения. При этом радикалы (R) аминокислотных молекул расположены снаружи по бокам пептидной цепи («хребта», основы полипептидной цепи). Радикалы соседних аминокислотных остатков полипептидной цепи также, как и пептидные группы, находятся в транс-положении, т.е. на противоположных сторонах «хребта» пептидной цепи.
Различные аминокислотные остатки полипептидной цепи отличаются величиной этих радикалов. Могут быть маленькие радикалы (как –Н- у глицина или –СН3- у аланина), или большие радикалы (как у триптофана или лейцина).
Существуют как неполярные радикалы (у валина, лейцина, фенилаланина и др.), так и незаряженные полярные (у тирозина, цистеина, серина и др.) и заряженные полярные радикалы (у лизина, аргинина, глютаминовой кислоты и др.).
Все функциональные группы белков находятся в боковых цепях (радикалах), а также в концевых аминной и соответственно карбоксильной группах на свободных концах пептидной цепи. Свободные карбоксильные группы в радикалах поставляются аспарагиновой и глютаминовой кислотами, свободные аминогруппы – лизином. Концевые —NH2 и -СООН-группы и радикалы, способные к ионизации, определяют кислотно-основные свойства пептидов (суммарный заряд).
Пептидная цепочка белков в принципе не разветвляется, так как только альфа-аминогруппа и соседняя с ней карбоксильная группа участвуют в образовании пептидных связей. Длина цепочки может быть очень различной, от нескольких десятков до многих сотен остатков аминокислот.
В настоящее время принять считать, что в одной цепочке может быть не более 600 аминокислотных остатков (коэффициент поликонденсации). Существуют белковые молекулы, состоящие из одной пептидной цепочки, в то время как другие построены из нескольких полипептидов.
Помимо пептидной связи, другой важной ковалентной связью в белках является дисульфидная, которая образуется в результате отщепления водорода из SH-групп двух цистеиновых остатков.
Дисульфидные связи – это прочные ковалентные связи, которые могут соединять как обособленные полипептидные цепи (например, у инсулина), так и отдельные точки одной цепи (например, у рибонуклеазы), что приводит к образованию в ней петель.
Помимо ковалентных связей в белках существуют нековалентные связи: водородная, ионная, неполярная.
Важную роль в поддержании структуры белковой молекулы играют водородные связи.
Поскольку в пептидной связи обнаруживается излишек электронов у кислородного атома в карбонильной группе и недостаток электронов у атома азота в иминогруппе, то в пептидной связи электроотрицательность СО- группы больше, чем в обычной кетогруппе; аналогично усилена электроположительность NH-группы. Поэтому кислородный атом карбонильной группы пептидной связи способен конкурировать за водородный атом, который связан с атомом азота иминной группы другой пептидной связи. Этот водородный атом притягивается атомом кислорода первой пептидной связи. Таким образом, водородный атом как связующее звено образует своего рода мост между атомами азота и кислорода, так называемый водородный мостик, как внутри одной и той же цепи, так и между разными пептидными цепями.
Водородные мостики могут возникать между радикалами соответствующих аминокислотных остатков, как, например, между имидазольным радикалом гистидина и гидроксильной группой тирозина или серина разных пептидных цепей, или внутри одной и той же цепи между первой и четвертой пептидными группами (межпептидные водородные связи).
Свободные карбоксильные группы и аминогруппы (концевые и в радикалах) остатков аминокислот пептидной цепи белка в физиологической области рН (т.е. при рН 7) находятся в ионизированной форме. Между ними поэтому возникают сильные электростатические силы притяжения, которые обозначают как электровалентные или ионные связи.
Наконец, между неполярными остатками различных аминокислот действуют силы Ван-дер-Ваальса, вызывающие лишь слабое притяжение, когда встречающиеся группы находятся достаточно близко друг от друга.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2620; Нарушение авторских прав?; Мы поможем в написании вашей работы!