
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Паули: в атоме не могут находиться два электрона в тождественных состояниях
|
|
|
|
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90 %-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90 %-ой плотности заряда электрона (как волны).
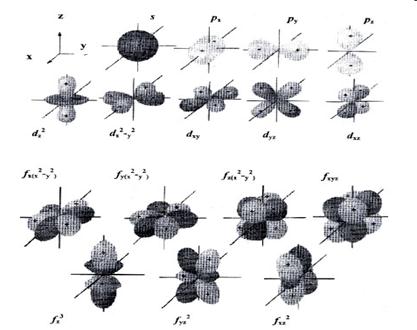
Модель атомной орбитали (электронного облака) очень удобна для наглядного описания распределения электронной плотности в пространстве. При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели, f-орбиталь – еще более сложную форму (рис. 3).
|
| Рис. 3. Формы s-, p-, d- и f -орбиталей |
Если в атомной орбитали находится только один электрон (как в атоме водорода), то говорят об однократно занятой или полузаполненной, полузаселенной атомной орбитали. Если же в атомной орбитали находятся два электрона (как в атоме гелия), то говорят о двукратно занятой или полностью заполненной, полностью заселенной атомной орбитали. Полузаселенные АО играют важнейшую роль при формировании химических связей.
В соответствии с квантово-механическим описанием состояния электрона в атоме каждый электрон является индивидуальной частицей. Такие его свойства, как масса и заряд не выявляют различий между электронами, особенно между теми электронами, которые находятся на одной атомной орбитали (как в атоме гелия). Собственной характеристикой каждого электрона в атоме является спин.
Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
Спин – квантово-механическое свойство электрона, которое невозможно точно объяснить с помощью традиционных представлений на основе механического поведения макрочастиц. Без учета волновых свойств электрона спин можно интерпретировать путем сравнения электрона с шаром, вращающимся вокруг выбранной оси. Спин характеризует направление вращения и, следовательно, при двух возможных направлениях механического вращения должно существовать два разных спина электрона.
Спин – неотъемлемая характеристика электрона в атоме; два электрона на одной атомной орбитали обладают антипараллельными спинами.
Атомную орбиталь удобно изображать в виде квадрата, называемого квантовой ячейкой, а каждый электрон − вертикальной стрелкой, обозначающей один из двух возможных спинов электрона. Квантовая ячейка с одной стрелкой означает атомную орбиталь с одним электроном, т.е. полузаселенную орбиталь, с двумя стрелками − атомную орбиталь с двумя электронами, т.е. полностью заселенную орбиталь, без стрелок – вакантную орбиталь, т. е. без электронов.
2.2.2. Орбитали с s, p, d - и f -электронами
(атомные s, p, d - и f -орбитали)
Атомную орбиталь, имеющую шаровую симметрию (рис. 3), принято обозначать как s-орбиталь (s-АО), а находящиеся в ней электроны – как s-электроны.
Радиус атомной s-орбитали возрастает при увеличении номера энергетического уровня; 1s-АО расположена внутри 2s-АО, последняя – внутри 3s-АО и т.д. с центром, отвечающим атомному ядру. В целом строение электронной оболочки атома в орбитальной модели представляется слоистым. Каждый энергетический уровень, содержащий электроны, геометрически рассматривается как электронный слой.
Для сокращенного обозначения электрона, занимающего атомную s-орбиталь, используется обозначение самой s-АО с верхним цифровым индексом, указывающим число электронов. Например, 1s − обозначение единственного электрона атома водорода.
− обозначение единственного электрона атома водорода.
Номер энергетического уровня отвечает главному квантовому числу, а вид орбитали − орбитальному квантовому числу.
2s  Li=1s
Li=1s 2s
2s ,
, 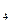 Be=1s
Be=1s 2s
2s
1s 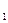 H=1s
H=1s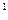 , He
, He
Электронная формула в сочетании с энергетической диаграммой электронной оболочки атома (рис. 3) отражают его электронную конфигурацию.
Атомную орбиталь, имеющую вращательную (осевую) симметрию принято обозначать как p-орбиталь (p -АО); находящиеся в ней электроны – это p -электроны.
Каждая атомная p-орбиталь может принять (при максимальном заполнении) два электрона, подобно любой другой АО. Эти электроны сообща занимают обе половины p -орбитали. На каждом атомном энергетическом уровне (кроме первого) имеется три атомных орбитали, которым отвечает максимальное заселение шестью электронами.
Все три p -АО одного энергетического уровня отличаются друг от друга пространственным расположением; их собственные оси, проходящие через обе половины орбитали и перпендикулярные ее узловой плоскости, образуют систему декартовых координат (обозначения собственных осей x, y, z). Поэтому на каждом энергетическом уровне имеется набор трех атомных p-орбиталей: px-, py- и pz-АО. Буквы x, y, z соответствуют магнитному квантовому числу, позволяющему судить о влиянии внешнего магнитного поля на электронную оболочку атома.
Атомные s-орбитали имеются на всех энергетических уровнях, атомные p -орбитали − на всех уровнях, кроме первого. На третьем и последующих энергетических уровнях к одной s-АО и трем p -АО присоединяется пять атомных орбиталей, получивших название d -орбиталей (рис. 4), а на четвертом и последующих уровнях − еще семь атомных орбиталей, называемых f -орбиталями.
Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня не одинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию.
Энергетический уровень характеризуется главным квантовым числом n. Для всех известных элементов значения n изменяются от 1 до 7. Электроны в многоэлектронном атоме, находящемся в основном (невозбужденном) состоянии, занимают энергетические уровни от первого до седьмого.
Энергетический подуровень характеризуется орбитальным квантовым числом l. Для каждого уровня (n = const) квантовое число l принимает все целочисленные значения от 0 до (n-1), например, при n=3 значениями l будут 0, 1 и 2. Орбитальное квантовое число определяет геометрическую форму (симметрию) орбиталей s-, p-, d-, f -подуровня. Очевидно, что во всех случаях n> l; при n=3 максимальное значение l равно 2.
Существующие подуровни для первых четырех энергетических уровней, числа атомных орбиталей и электронов в них приведены в таблице 1.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г. швейцарским физиком Паули.
Различие электронов, занимающих разные атомные орбитали одного подуровня (n, l = const), кроме s-подуровня, характеризуется магнитным квантовым числом m . Это число называется магнитным, поскольку оно характеризует поведение электронов во внешнем магнитном поле. Если значение l определяет геометрическую форму атомных орбиталей подуровня, то значение квантового числа m
. Это число называется магнитным, поскольку оно характеризует поведение электронов во внешнем магнитном поле. Если значение l определяет геометрическую форму атомных орбиталей подуровня, то значение квантового числа m устанавливает взаимное пространственное расположение этих орбиталей.
устанавливает взаимное пространственное расположение этих орбиталей.
Таблица 1
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 450; Нарушение авторских прав?; Мы поможем в написании вашей работы!