
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общий кислотно-основной катализ
|
|
|
|
1) Первичный солевой эффект – проявляется в том, что если к реакции, катализируемой кислотой, прибавить соль другой кислоты, то может наблюдаться усиление каталитического действия. Причиной этого, согласно Оствальду, является усиление электрической проводимости раствора. Пример: инверсия тростникового сахара в уксусной кислоте усиливается при добавлении NaCl.
2) Вторичный солевой эффект – если к раствору, катализируемому кислотой, прибавить соль этой же кислоты, то может наблюдаться усиление каталитического действия. Это объясняется не увеличением электропроводимости раствора, а участием в катализе непродиссоциировавших молекул кислоты и ее анионов. Пример: этерификация трихлоруксусной кислоты. На самом деле, согласно теории, каталитическое действие кислоты должно уменьшаться, так как добавление ее соли будет уменьшать концентрацию Н+ и электропроводимость будет падать. Однако, каталитическое действие начинают проявлять непродиссоциировавшие молекулы кислоты и ее анионы, что приводит ко вторичному солевому эффекту.
В кислотно-основном катализе различают следующие типы реакций.
1. Специфический кислотный и основной катализ. Сюда относят реакции, в которых активация субстрата осуществляется только ионами водорода и ионами гидроксила соответственно.
2. Общий кислотный и основной катализ – реакции с активацией субстрата любым донором протонов, кроме ионов водорода, т.е. под действием обобщенных кислот Бренстеда; и реакции с активацией любым акцептором протонов, кроме 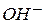 , т.е. обобщенным основанием Бренстеда соответственно.
, т.е. обобщенным основанием Бренстеда соответственно.
3. Электрофильный и нуклеофильный катализ – это реакции, в которых катализатором является, соответственно, кислота и основание Льюиса.
4. Общий кислотно-основной катализ – в каталитической реакции одновременно участвуют Брестедовские кислота и основание.
5. Электрофильно-нуклеофильный катализ – в реакции участвуют одновременно кислота и основание Льюиса.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1951; Нарушение авторских прав?; Мы поможем в написании вашей работы!