
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Специфический кислотно-основной катализ
|
|
|
|
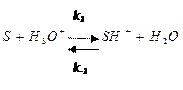 Случай, когда первая стадия протекает быстро, а вторая стадия – лимитирующая. Общая схема кислотного катализа (специфический кислотный катализ) может быть представлена схемой:
Случай, когда первая стадия протекает быстро, а вторая стадия – лимитирующая. Общая схема кислотного катализа (специфический кислотный катализ) может быть представлена схемой:
 (равновесная стадия процесса),
(равновесная стадия процесса),
(лимитирующая стадия процесса),
где  - субстрат,
- субстрат,  - протонированный субстрат.
- протонированный субстрат.
 Общая схема основного катализа (специфический основной катализ) может быть представлена схемой:
Общая схема основного катализа (специфический основной катализ) может быть представлена схемой:
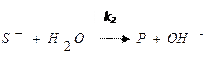 (равновесная стадия процесса),
(равновесная стадия процесса),
(лимитирующая стадия процесса),
где 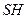 - протонированный субстрат,
- протонированный субстрат, 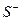 - депротонированный субстрат.
- депротонированный субстрат.
Специфический кислотный катализ характерен для реакций дегидратации спиртов и кето-енольной таутомеризации, а специфический основной катализ – для альдольной конденсации. Гидролиз сложных эфиров ускоряется как в кислой, так и в щелочной среде.
Кинетику таких реакций рассмотрим на примере специфического кислотного катализа.
Скорость лимитирующей стадии равна:
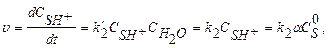 (1.5)
(1.5)
где  ;
; 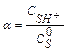 - степень протонизации субстрата.
- степень протонизации субстрата.
 Если равновесие в первой стадии устанавливается быстро, то соотношение активностей реагентов практически не отличается от равновесного и определяется константой равновесия:
Если равновесие в первой стадии устанавливается быстро, то соотношение активностей реагентов практически не отличается от равновесного и определяется константой равновесия:
(1.6)
 Откуда
Откуда
(1.7)
где  - кислотность среды. В разбавленном водном растворе все коэффициенты активности и активность воды равны 1, поэтому кислотность совпадает с концентрацией ионов гидроксония:
- кислотность среды. В разбавленном водном растворе все коэффициенты активности и активность воды равны 1, поэтому кислотность совпадает с концентрацией ионов гидроксония: 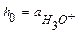 .
.
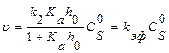 Подставим (1.7) в выражение (1.5) и учитывая, что
Подставим (1.7) в выражение (1.5) и учитывая, что 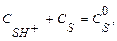 получим выражение для скорости реакции:
получим выражение для скорости реакции:
(1.8)
 Откуда
Откуда
(1.9)
 Представим это соотношение в виде обратной зависимости:
Представим это соотношение в виде обратной зависимости:
(1.10)
В этом случае по зависимости 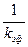 от
от 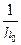 можно определить отдельно
можно определить отдельно  и
и .
.
Из уравнения (1.9) находим, что если  то
то
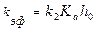 (1.11)
(1.11)
 Прологарифмировав это уравнение, получим:
Прологарифмировав это уравнение, получим:
(1.12)
где логарифм кислотности, взятый с обратным знаком, называется функцией кислотности Гаммета:
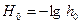 (1.13)
(1.13)
Согласно зависимости (1.12) график, построенный в координатах 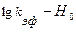 имеет тангенс угла наклона, равный -1. Величину
имеет тангенс угла наклона, равный -1. Величину  используют для характеристики кислотности среды в концентрированных водных растворах, где активности значительно отличаются от концентраций. В разбавленных растворах функция кислотности совпадает с водородным показателем:
используют для характеристики кислотности среды в концентрированных водных растворах, где активности значительно отличаются от концентраций. В разбавленных растворах функция кислотности совпадает с водородным показателем:  . Если даже
. Если даже  то
то  .
.
Аналогичные соотношения справедливы и для специфического основного катализа, где  - константа депротонизации субстрата.
- константа депротонизации субстрата.
 Общий кислотный и основной катализ осуществляется кислотами (НА) или основаниями (В) Бренстеда:
Общий кислотный и основной катализ осуществляется кислотами (НА) или основаниями (В) Бренстеда:
- общий кислотный катализ,
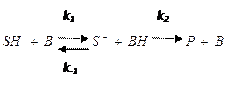
- общий основной катализ.
В этом случае каталитический эффект зависит от природы кислоты или основания, которые служат катализаторами. Эта зависимость определяется, главным образом, силой кислоты или основания.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1369; Нарушение авторских прав?; Мы поможем в написании вашей работы!