
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика гетерогенных каталитических реакций в статических условиях
|
|
|
|
Рассмотрим процесс, в котором реагирующее вещество газ, а катализатор – твердое тело. При этом пусть реагирует одно вещество, а продукты реакции не адсорбируются и не тормозят процесс. Примером является распад NH3 на Pt.
Как сказано выше, в типичном гетерогенном процессе реагируют только те вещества, которые адсорбированы на поверхности.
Скорость гетерогенных химических реакций – это количество вещества, реагирующего в единицу времени на единицу площади поверхности катализатора:

где х – количество вещества, прореагировавшего к моменту времени t;
S – общая площадь поверхности катализатора, на которой идет химический процесс.
Согласно постулату химической кинетики, скорость гетерогенных реакций 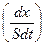 прямо пропорциональна поверхностной концентрации веществ. Последняя, в свою очередь, прямо пропорциональна степени заполнения поверхности Θ:
прямо пропорциональна поверхностной концентрации веществ. Последняя, в свою очередь, прямо пропорциональна степени заполнения поверхности Θ:
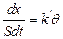
Так как поверхность катализатора постоянна, то внесем S под величину знака константы скорости 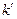 :
:
 ,
,
тогда:

Величину поверхности (Θ), занятую реагирующим веществом на 1 см2 поверхности катализатора, можно найти, исходя из изотермы адсорбции Лэнгмюра:


где К – константа равновесия адсорбции или адсорбционный коэффициент; р – давление газа.
Уравнение Лэнгмюра имеет 2 формы:
а) Если адсорбция мала, то величиной К.р в знаменателе пренебрегаем:

То есть при малых давлениях поверхность, занятая адсорбированным веществом, прямо пропорциональна давлению. Эта область называется областью линейной адсорбции.
б) Если адсорбция велика, то К . р>>1, то пренебрегаем в знаменателе единицей:

Это уравнение является уравнением асимптомы кривой, описываемой уравнением Лэнгмюра.
Пользуясь уравнением Лэнгмюра, можно получить кинетические уравнения гетерогенных реакций:
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1361; Нарушение авторских прав?; Мы поможем в написании вашей работы!