
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Истинная и кажущаяся энергии активации гетерогенных химических реакций
|
|
|
|
Если построить экспериментально полученный график зависимости кажущейся k* гетерогенной реакции от 1/Т, то получим прямую, которая может описываться уравнением Аррениуса.
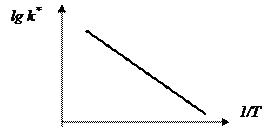 |
Тогда уравнение зависимости k* от 1/Т запишется как и уравнение Аррениуса:

Или после дифференцирования по температуре Т:
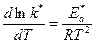
Величина  называется кажущейся энергией активации. Между кажущейся и истинной энергиями активации гетерогенных реакций существует определенная зависимость. Найдем эту зависимость.
называется кажущейся энергией активации. Между кажущейся и истинной энергиями активации гетерогенных реакций существует определенная зависимость. Найдем эту зависимость.
1. Пусть протекает гетерогенная каталитическая реакция с участием одного реагирующего вещества (А) – газа, который слабо адсорбируется, а продукт реакции не тормозит процесс. Кажущаяся k* равна:

где K – адсорбционный коэффициент (или константа равновесия адсорбции) который равен отношению констант скорости процессов адсорбции k1 и десорбции k2. Тогда:
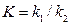 ;
; 
При этом каждая из констант является функцией температуры Т.
а) где исходя из уравнения изотермы адсорбции Лэнгмюра, константа k1 адсорбции обратно пропорциональна 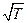 :
:
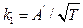 ,
,
где  – постоянная величина.
– постоянная величина.
б) Константа k2 десорбции изменяется с температурой так же, как и давление насыщенного пара, то есть
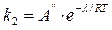 ,
,
где 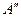 – постоянная, не зависящая от Т; λ – теплота адсорбции.
– постоянная, не зависящая от Т; λ – теплота адсорбции.
в) Константа скорости k химической реакции изменяется с изменением температуры согласно уравнению Аррениуса:
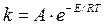
Константа k1 адсорбции мало изменяется с изменением температуры (из-за малого изменения  с ростом температуры Т), поэтому зависимостью k1 от температуры пренебрегаем и считаем, что k1= const. Тогда:
с ростом температуры Т), поэтому зависимостью k1 от температуры пренебрегаем и считаем, что k1= const. Тогда:

Прологарифмируем
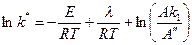
Дифференцируем по температуре Т:
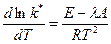
Сравнивая с уравнением: 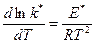 , получим:
, получим:
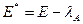
Кажущаяся энергия активации Е* меньше истинной энергии Е на величину теплоты адсорбции реагирующего вещества (λ).
2. Рассмотрим случай, когда реагирующее вещество А адсорбируется слабо, а продукт реакции В – сильно (то есть он способен за счет адсорбции на поверхности катализатора тормозить процесс катализа):

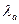 и
и  – теплоты адсорбции соответственно веществ А и В.
– теплоты адсорбции соответственно веществ А и В.
Таким образом, для расчета по данным уравнениям истинных энергий активации необходимо знать теплоты адсорбции реагирующих веществ и продуктов реакции, а также кажущуюся энергию активации Е* из уравнения Аррениуса.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 8249; Нарушение авторских прав?; Мы поможем в написании вашей работы!