
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Интегральное уравнение для константы скорости необратимой реакции второго порядка
|
|
|
|
Размерность k [л/моль·с]
Величина τ1/2 в этом случае применима только к одному из веществ – или А, или В. Выведем уравнение для τ1/2(А).
Пусть  , тогда
, тогда 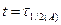 . Подставим х и t в уравнение для k:
. Подставим х и t в уравнение для k:
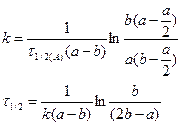
Аналогично выводим для 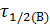 .
.
Б. Рассмотрим случай, когда количества исходных реагирующих веществ равны (а=в).
Если a=b, то дифференциальное уравнение скорости бимолекулярной необратимой реакции второго порядка будет иметь вид:
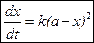
Разделим переменные и проинтегрируем в пределах от 0 до t и от 0 до х:
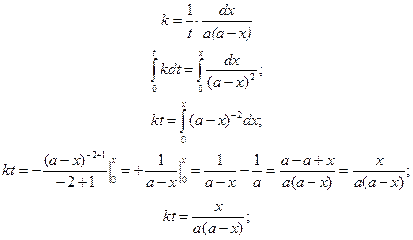
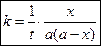
Если количество прореагировавшего вещества будет равно половине исходного 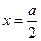 , то значение t будет равно τ – времени полураспада. Подставим τ и
, то значение t будет равно τ – времени полураспада. Подставим τ и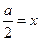 получим уравнение для τ:
получим уравнение для τ:
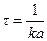
Время полураспада для необратимой реакции II порядка обратно пропорционально количеству исходного вещества.
3. Необратимая реакция n- го порядка
В общем случае стехиометрическое уравнение n -го порядка имеет вид:
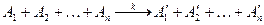
| В начальный момент t=0 | а a … a |
| Прореагировало к моменту t | x x … x |
| Осталось | (a-x) (a-x)…(a-x) |
 Если реакция протекает при условии, что объем V=const, то число молей реагирующих веществ в момент времени t=0 (начальный) одинаково. К моменту времени t прореагирует x молей вещества А и останется a-x. Согласно основному постулату химической кинетики скорость реакции n -го порядка прямо пропорциональна концентрации реагирующего вещества в степени n.
Если реакция протекает при условии, что объем V=const, то число молей реагирующих веществ в момент времени t=0 (начальный) одинаково. К моменту времени t прореагирует x молей вещества А и останется a-x. Согласно основному постулату химической кинетики скорость реакции n -го порядка прямо пропорциональна концентрации реагирующего вещества в степени n.
На основании этого имеем скорость реакции n-го порядка к моменту времени t:

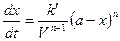
Так как V=const, то вносим V под знак k:
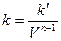
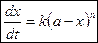
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 907; Нарушение авторских прав?; Мы поможем в написании вашей работы!