
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: обратимые реакции
|
|
|
|
План: 1. Принципы, лежащие в основе кинетики сложных реакций.
2. Мономолекулярная обратимая реакция первого порядка.
1. Принципы, лежащие в основе кинетики сложных реакций.
Скорость простых (необратимых) реакций описывается только с помощью основного постулата химической кинетики.
При изучении сложных реакций (обратимых, параллельных, последовательных, сопряженных и т.д.) наличие одного постулата химической кинетики недостаточно для описания скорости реакций. В случае сложных реакций применяются еще три принципы (постулата):
1. Принцип независимости химических реакций – каждая из реакций сложного химического процесса протекает независимо от остальных реакций и к ней можно применить основной постулат химической кинетики. Этот постулат не применяется для сопряженных реакции.
2. Принцип лимитирующей стадии – общая скорость любого сложного процесса, который состоит из ряда последовательных стадий, определяется скоростью наиболее медленной стадии. Не применяется для параллельных реакций, где общая скорость процесса определяется наиболее быстрой стадией.
3. Принцип детального равновесия – при достижении химического равновесия для каждой из стадий сложной реакции скорость прямой и обратной реакции становятся равными.
2. Мономолекулярная обратимая реакция первого порядка.
Обратимая реакция – химическая реакция, которая протекает одновременно в двух противоположных направлениях (прямом и обратном).
Примером обратимой реакции первого порядка есть мутаротация глюкозы:

В общем случае стехиометрическое уравнение мономолекулярной обратимой реакции первого порядка имеет вид:
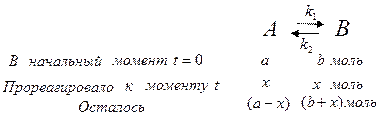
где 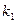 - скорость прямой реакции,
- скорость прямой реакции, 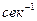 ;
;
 - скорость обратной реакции,
- скорость обратной реакции, 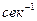 ;
;
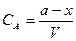 – концентрация оставшегося вещества A к времени t;
– концентрация оставшегося вещества A к времени t;
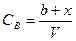 – концентрация оставшегося вещества B к времени t.
– концентрация оставшегося вещества B к времени t.
Из принципа независимости: если в системе одновременно протекает несколько реакций, то каждая из них независима от других и к ней можно применить основной постулат химической кинетики.
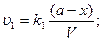

Общая скорость обратимой реакции к моменту времени t равняется разнице скоростей прямой и обратной реакции:


|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!