
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение теории активного комплекса для скорости химической реакции
|
|
|
|
Вывод константы скорости химической реакции рассмотри на примере бимолекулярной реакции:
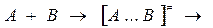 конечные продукты
конечные продукты
Согласно основному постулату химической кинетики:
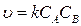
С учетом скорости по теории активного комплекса имеем:
 =
= 
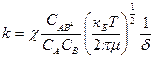
Далее предположим, что при отсутствии химического равновесия константа скорости реакции ( ) будет мало отличаться от константы скорости того же процесса, если предположить, что равновесие есть, согласно принципа независимости протекания прямой и обратной реакции. Поэтому допускают, что есть химическое равновесие между исходными веществами и активным комплексом. Такое предположение является основным недостатком теории активного комплекса, т.к. на самом деле такого равновесия не существует:
) будет мало отличаться от константы скорости того же процесса, если предположить, что равновесие есть, согласно принципа независимости протекания прямой и обратной реакции. Поэтому допускают, что есть химическое равновесие между исходными веществами и активным комплексом. Такое предположение является основным недостатком теории активного комплекса, т.к. на самом деле такого равновесия не существует:

Тогда примем, что С=С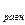

| (2) |
Множитель, содержащий равновесные концентрации, можно заменить константой химического равновесия исходных веществ с конфигурацией атомов, соответствующей активному комплексу

Из статистической термодинамики константу равновесия можно выразить через статистические суммы состояний соответствующих веществ:

| (3) |
где Е - энергия активации при абсолютном нуле,
- энергия активации при абсолютном нуле,
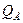 и
и 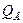 - статистическая сумма состояний веществ А и В для электронной, вращательной и колебательной энергий
- статистическая сумма состояний веществ А и В для электронной, вращательной и колебательной энергий
Статистическая сумма состояния активного комплекса (в отличие от молекулы) содержит еще и в виде множителя статистическую сумму поступательного движения вдоль пути реакции 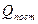 , т.е.
, т.е.

Из статистической механики для статистической суммы поступательного движения в трехмерном пространстве объемом V имеем:

Так как поступательное движение в объеме имеет три степени свободы, то для одной степени свободы вдоль координаты реакции извлечем кубический корень из этого уравнения:
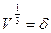 (будет соответствовать рассмотренному участку пути
(будет соответствовать рассмотренному участку пути 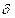 )
)
Тогда:

где 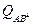 - статистическая сумма состояний АК для электронной, вращательной и колебательной энергий и 2-х степеней свободы поступательного движения.
- статистическая сумма состояний АК для электронной, вращательной и колебательной энергий и 2-х степеней свободы поступательного движения.
Подставим полученное выражение в (3) для константы равновесия:
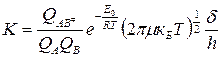 ,
,
где 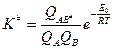 - константа равновесия между активным комплексом и исходными веществами без учета поступательного движения вдоль координаты реакции. Тогда
- константа равновесия между активным комплексом и исходными веществами без учета поступательного движения вдоль координаты реакции. Тогда
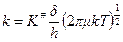
| (4) |
Подставим получившееся уравнение (4) в уравнение (2) и получим:

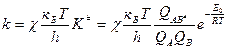 уравнение теории активного комплекса для константы скорости бимолекулярной реакции.
уравнение теории активного комплекса для константы скорости бимолекулярной реакции.
| (5) |
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 432; Нарушение авторских прав?; Мы поможем в написании вашей работы!