
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свободная энергия активации
Из термодинамики известно, что константа равновесия связана со свободной энергией процесса. Эту связь можно использовать и для нахождения величины 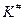 - константы равновесия между активным комплексом и исходными веществами. Для этого вводят понятие свободной энергии активации – это величина, характеризующая изменение свободной энергии при переходе системы из исходного состояния в переходное при учете всех степеней свободы кроме координаты реакции.
- константы равновесия между активным комплексом и исходными веществами. Для этого вводят понятие свободной энергии активации – это величина, характеризующая изменение свободной энергии при переходе системы из исходного состояния в переходное при учете всех степеней свободы кроме координаты реакции.
1) Для системы в стандартном состоянии (Р = const = 1 атм) свободная энергия активации реакции, протекающей при V = const, равна:
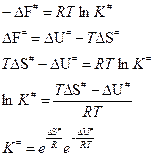
Подставим в выражение для константы скорости 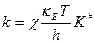 :
:
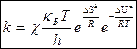 уравнение для константы скорости реакции, протекающей при V = const
уравнение для константы скорости реакции, протекающей при V = const
| (1) |
где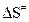 - изменение энтропии активации;
- изменение энтропии активации;
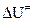 - изменение внутренней энергии активации.
- изменение внутренней энергии активации.
2) Если процесс протекает при Р = const:
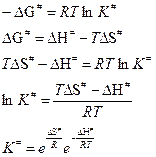
Отсюда выражение для константы скорости реакции, протекающей при Р = const:
 уравнение для константы скорости реакции, протекающей при P = const
уравнение для константы скорости реакции, протекающей при P = const
| (2) |
В этих уравнениях 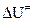 и
и  имеют физический смысл теплот активации, а
имеют физический смысл теплот активации, а 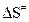 - энтропия активации.
- энтропия активации.
Однако, величины 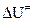 и
и  - это не экспериментально определенные энергии активации, а изменения внутренней энергии и энтальпии при переходе исходных молекул в состояние активного комплекса.
- это не экспериментально определенные энергии активации, а изменения внутренней энергии и энтальпии при переходе исходных молекул в состояние активного комплекса.
Для практических расчетов в выражения для констант скоростей (1) и (2) необходимо ввести экспериментально определенную энергию активации. Для этого прологарифмируем выражение для константы скорости при P = const (и пометим индексом p):

Проинтегрируем и с учетом уравнения Аррениуса будем иметь:
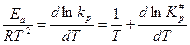 ,
,
Где Еа – экспериментально определенная энергия активации.
Согласно уравнению изобары химической реакции:
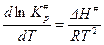
Тогда 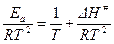
 , т.к. RT <<
, т.к. RT <<  , то Еа ≈
, то Еа ≈ 

Заменим  на Еа
на Еа

|
Дата добавления: 2014-01-06; Просмотров: 1965; Нарушение авторских прав?; Мы поможем в написании вашей работы!