
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для насыщенных молекул известны четыре реакции в газовой фазе с участием окиси азота
|
|
|
|
2NO + O2 → 2NO2
2NO + Cl2 → 2NOCl
2NO + Br2 → 2NOBr
2NO + H2 → H2O + N2O
Из экспериментальных данных известно, что для этих реакций с увеличением Т скорость реакции падает.
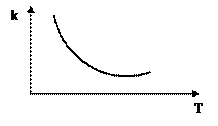 Это является аномальным и противоречит уравнению Арреиуса.
Это является аномальным и противоречит уравнению Арреиуса.
Попытка объяснить такую зависимость и установить механизм тримолекулярных реакций принадлежит Траутцу. Он рассмотрел тримолекулярные реакции как двухстадийные процессы.
Рассмотрим механизм тримолекулярной реакции на примере образования хлористого нитрозила.
I стадия – полностью равновесная, заключается в присоединении молекулы NO, обладающей неспаренным электроном, к молекуле хлора:
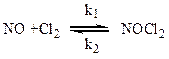
Согласно условию равновесия скорость образования промежуточного соединения NOCl2 равна:


II стадия — медленная, определяет скорость процесса в целом. Это реакция взаимодействия промежуточного соединения со второй молекулой NO:
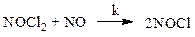
Скорость образования хлористого нитрозила:


То есть кинетически процесс является реакцией третьего порядка.
При возрастании температуры равновесие сдвигается в сторону исходных веществ в первой стадии, поэтому скорость реакции падает за счет уменьшения концентрации NOCl2.
Качественно такие же результаты для тримолекулярной реакции получаются и с точки зрения теории столкновений: с ростом Т возрастает скорость сталкивающихся молекул и уменьшается время жизни сталкивающейся пары. Таким образом, число тройных столкновений должно несколько уменьшаться с температурой.
 Применение теории АК к тримолекулярным реакциям весьма затруднительно, так как отсутствуют сведения о составе и конфигурации АК. Поэтому остается гипотетически принять наиболее правдоподобную форму активного компонента, и, исходя из нее, рассчитывать соответствующие суммы состояний. Ошибка расчетов очень велика.
Применение теории АК к тримолекулярным реакциям весьма затруднительно, так как отсутствуют сведения о составе и конфигурации АК. Поэтому остается гипотетически принять наиболее правдоподобную форму активного компонента, и, исходя из нее, рассчитывать соответствующие суммы состояний. Ошибка расчетов очень велика.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 319; Нарушение авторских прав?; Мы поможем в написании вашей работы!