
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аномальная подвижность ионов гидроксония и гидроксила
|
|
|
|
Зависимость предельной подвижности от радиуса иона (уравнение Стокса) и температуры (правило Вальдена-Писаржевского).
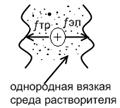 Стокс предложил простейшую модель движения иона в растворе, согласно которой движение иона в растворе уподобляется движению заряженного шарика в однородной вязкой среде. Согласно закону Стокса, ƒ тр, действующая на шарообразную частицу с радиусом r, движущуюся со скоростью vi в однородной среде с вязкостью η, равна
Стокс предложил простейшую модель движения иона в растворе, согласно которой движение иона в растворе уподобляется движению заряженного шарика в однородной вязкой среде. Согласно закону Стокса, ƒ тр, действующая на шарообразную частицу с радиусом r, движущуюся со скоростью vi в однородной среде с вязкостью η, равна

η – коэффициент вязкости растворителя;
r – радиус иона;
vi – скорость движения иона.
Электрическая сила, вызывающая движение иона, равна
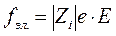
где 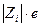 - заряд иона;
- заряд иона;
Е – напряженность электрического поля;
В стационарном состоянии, когда ион равномерно движется в растворе, эти две силы равны:

 ;
;
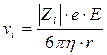
Известно, что 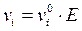 , т. к. мы рассматриваем абсолютную подвижность иона, то Е = 1, тогда
, т. к. мы рассматриваем абсолютную подвижность иона, то Е = 1, тогда
 ;
; 
Т. к.  , то для предельно разбавленного раствора
, то для предельно разбавленного раствора 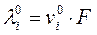 , тогда
, тогда 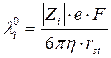 - уравнение Стокса, согласно которому скорость движения ионов обратно пропорциональна их радиусу. Из данного уравнения можно найти радиус иона rst, называемый стоксовским радиусом.
- уравнение Стокса, согласно которому скорость движения ионов обратно пропорциональна их радиусу. Из данного уравнения можно найти радиус иона rst, называемый стоксовским радиусом.
Это утверждение неверно, т. к. в ионной решетке и в растворе ионы обладают разными радиусами. Причем, чем меньше истинный (кристаллический) радиус иона, тем больше его эффективный радиус в растворе электролита.
Для справки:
Истинный радиус у иона в кристаллической решетке.
| Ион | λ0i Ом-1 · см2 · (г · экв)-1 при 25 0С |
| Li+ Na+ K+ | 38,6 50,1 73,1 |
| NO3- ClO3- BrO3- | 71,4 64,6 55,8 |
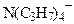
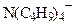
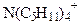
| 23,5 19,4 17,4 |
 Эффективный радиус у иона в растворе за счет сольватной (гидратной) оболочки из молекул растворителя
Эффективный радиус у иона в растворе за счет сольватной (гидратной) оболочки из молекул растворителя

H+ не может долго существовать и присоединятся к H2O образуя H3O+.
Ионы гидраксония H3O+ (часто называют ионы водорода Н+) и гидроксила ОН- образуется в процессе диссоциации воды:

В водных растворах λ0i этих ионов в несколько раз превышают предельные подвижности других ионов
| Ион | λОi Ом-1 · см2 · (г · экв)-1 при 25 0С |
| H3O+ OH- Li+ Na+ Li+ | 349,8 198,3 38,68 50,10 78,84 |
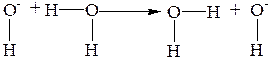
Это явление обусловлено особым эстафетным механизмом проводимости ионов H3O+ и OH-. Эстафетный механизм состоит в непрерывном переходе H+ от H3O+к молекуле H2O и от H2O к ионам OH-.
В кислой среде:
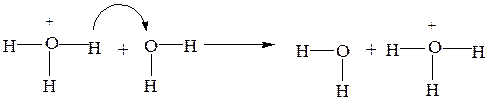

В щелочной среде:

Основные закономерности изменения подвижности H3O+ и OH-
1. Подвижность H3O+ больше чем у OH-, т. к. H+ труднее отщепляется от стабильной молекулы H2O, чем от иона;
Несмотря на высокую подвижность H3O+ и OH- вода является диэлектриком, т. к. количество ионов в воде мало 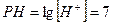 ;
;  Электричество переносится в основном не ионами H3O+ и OH-, а протонами H+;
Электричество переносится в основном не ионами H3O+ и OH-, а протонами H+;
2. 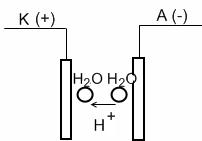 Скорость движения H+ по эстафетному механизму велика, что приводит к увеличению электропроводности раствора. Это обусловлено том, что H+ имеет малый радиус и проходит не весь путь до катода, а лишь расстояние между H2O. Такой тип электропроводности называется эстафетным или цепным. Именно из-за кислот и оснований имеют большую электропроводность.
Скорость движения H+ по эстафетному механизму велика, что приводит к увеличению электропроводности раствора. Это обусловлено том, что H+ имеет малый радиус и проходит не весь путь до катода, а лишь расстояние между H2O. Такой тип электропроводности называется эстафетным или цепным. Именно из-за кислот и оснований имеют большую электропроводность.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3354; Нарушение авторских прав?; Мы поможем в написании вашей работы!