
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Секреция факторов патогенности
|
|
|
|
Большинство бактерий способны секретировать протеины, такие как токсины и гидролитические ферменты, в окружающую среду. У грамотрицательных бактерий эти белки должны быть транспортированы через две мембраны клеточной оболочки и различные системы могут обеспечивать этот процесс. Все эти системы должны специфически распознавать свои субстраты и облегчать секрецию без нарушения целостности клеточной оболочки. Однако для достижения такой цели эти системы используют существенно разные механизмы и отличаются друг от друга по своей сложности.
Две из семи более или менее детально охарактеризованных систем (рис. 1) относятся к так называемым двухэтапным (или двухшаговым). Первый этап такой секреции заключается в переносе предназначенного для секреции белка из цитоплазмы бактериальной клетки в периплазматическое пространство. Для его осуществления у бактерий существует два механизма. Один из них называется двуаргининовый путь (в английской аббревиатуре - ТАТ, от pathway от t wo- a rginine t ranslocation), второй – Sec-путь (от английского sec retory – секреция).
Оба эти пути перемещения белков через мембраны функционируют в клетках организмов всех уровней клеточной организации – соответствующие им белки обнаружены у архей, эубактерий и эукариот. Sec-путь предназначен для транспорта белков, не прошедших пострансляционный фолдинг, в то время как ТАТ-путь обеспечивает провеление через мембрану белков, полностью принявших характерную для их активной формы пространственную конформацию.
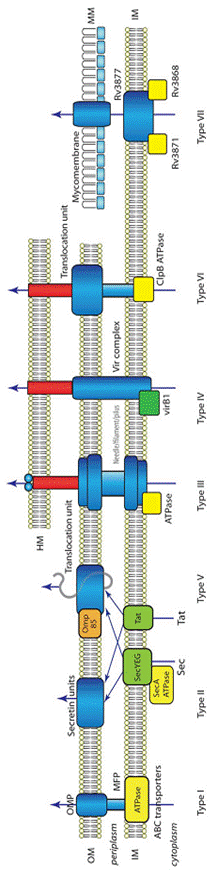
| Рис. 1. Бактериальные системы секреции белков и нуклеопротеидов. HM – мембрана клетки организма-хозяина; IM – внутренняя мембрана бактериальной клетки; OM – наружная мембрана клетки грамотрицательных бактерий; MM – наружная мембрана клетки микобактерий (микомембрана); OMP – белки, интегрированные в наружную мембрану (outer membrane proteins); MFP – белки, обеспечивающие соединение внутренней и наружной мембран (membrane fusion proteins). Остальные пояснения приводятся в тексте при описании систем секреции. |
У прокариот, в том числе и патогенных, Sec-путь обеспечивается цитоплазматическим белком SecА и тремя интегрированными в цитоплазматическую мембрану белками SecY, SecE и SecG. Белки, предназначенные для транспорта этим путем, имеют на своем N-конце сигнальную последовательность, с которой еще во время трансляции связывается белок SecА. Далее самостоятельно или с помощью белка-шаперона SecВ (этот шаперон нужен некоторым белкам для предотвращения сворачивания уже готовой белковой цепи в нативную структуру) SecА-белок доставляет направляющийся на секрецию белок к тому месту внутренней мембраны, где находятся белки SecY, SecE и SecG. SecА прикрепляет секретируемый белок к белку SecY и одновременно обеспечивает процесс транслокации энергией, поскольку обладает АТФазной активностью. Транслоцируемый белок через образованную белками SecY, SecE и SecG пору перемещается в периплазматическое пространство, и специальная пептидаза отщепляет от него сигнальную последовательность, после чего освободившийся от связи с мембраной белок может принять нативную конформацию.
ТАТ-путь реализуется для белков, у которых в сигнальной последовательности, тоже расположенной на N-конце, имеется характерное сочетание аминокислотных остатков с двумя остатками аргинина: S/TRRXFLK (в расшифрованном виде слева направо - остатки серина, треонина, два остатка аргинина, любой аминокислотный остаток, фенилаланина, лейцина, лизина). Еще раз подчеркнем, что через ТАТ-систему проводятся белки уже в своей окончательной конформации и чаще всего это белки, включающие небелковый компонент, например содержащий металлы кофактор. Поэтому канал, который формирует ТАТ-система в мембране имеет диаметр, позволяющий пройти белкам с поперечными размерами около 70 ангстрем, тогда как пора в Sec-пути имеет диаметр соответствующий толщине α-спирали белковой молекулы – около 12 ангстрем. Для формирования широкого канала в ТАТ-пути объединяются несколько десятков молекул белка TatА, которые первоначально встроены в мембрану как отдельные субъединицы. В то же время, при выведении в периплазму не принявшего окончательную конформацию белка по Sec-пути, достаточно иметь в мембране тример из белков SecY, SecE и SecG.
Последовательность происходящих при использовании ТАТ-пути событий иллюстрирует рисунок 2. На первом этапе предназначенный для секреции белок связывается с комплексом TatС, который специфически узнает последовательность S/TRRXFLK в сигнальном пептиде. Это вызывает перестройку в находящемся рядом комплексе TatB, что приводит к созданию в этом месте мембраны протонного градиента. Наличие протонного градиента и связанного предназначенного для секреции белка приводит к перемещению отдельно расположенных в мембране молекул TatА-белка и их олигомеризации в кольцевую структуру. Вокруг секретируемого белка объединяется несколько десятков молекул (в среднем их количество определено как 25), и эта кольцевая структура имеет внутренний диаметр, достаточный для прохождения белка в периплазму. После этого начинается третий этап. Предположительно с участием протонного градиента белок втягивается в образовавшуюся пору, и специальная мембранная пептидаза отрезает белок от сигнальной последовательности. После того, как секретированный белок оказывается в периплазме в свободном состоянии, осуществляется этап 4 – переход ТАТ-системы в исходное состояние. При появлении в цитоплазме новых молекул с соответствующими сигнальными пептидами процесс секреции повторяется.
У архей и грамположительных бактерий, не имеющих расположенных поверх клеточной стенки мембран (за исключением микобактерий, клеточная стенка которых имеет особые свойства и

| Рис. 2. Схема фнкционирования ТАТ-системы. Комплекс TatB, изображенный для упрощения рисунка как единая ничная структура состоит из шести молекул TatB, комплекс TatC – из 8 молекул TatС. Количество изоброженных отдельно друг от друга молекул TatA точно не известно, но должно составлять несколько десятков. Сисмволом RR и красным цветом обозначен сигнальный пептид на N-конце секретируемого белка, содержащий последовательность с двумя остатками аргиннинга.PMF - силы протонного градиента (от анл. proton-motif force). Описание этапов функционирования (1 – 4) приведено в тексте. |
называется микомембраной), Sec- и ТАТ-пути могут обеспечивать выведение некоторых белков непосредственно в окружающую среду. У грамотрицательных бактерий они проявляют себя как первые ступени двуступенчатых системам секреции, каковыми являются система секреции типа II (T2SS) и система секреции типа V (T5SS).
В остальных пяти системах секреции транспорт белков обеспечивается специальными каналами, непосредственно соединяющими цитоплазму бактериальной клетки с окружающей средой или же цитоплазмой клетки организма-хозяина.
Одной из таких систем является система секреции типа I или сокращенно T1SS. Общая схема строенияэтой системы включает три основных компонента: АТФ-связывающую кассету (сокращенно АВС от англ. A TP- b inding c assette); белки, обеспечивающие соединение мембран (сокращенно MFP от англ. m embrane f usion p rotein) и белки, закрепленные в наружной мембране (сокращенно OMFs от англ. о uter m embrane f actors),
Одним из примеров такой системы считается система, обеспечивающая секрецию a-гемолизина (белка HlyА) энтеропатогеными E. coli, которая формируется из белков HlyB (функционально соответствует АВС), HlyD (соответствует MFP) и TolC (соответствует OMF). У бактерий других видов белки T1SS и кодирующие их гены носят различные названия, но функционально они будут соответствовать АВС-белку; белку, соединяющему мембраны, и порообразующему белку. Такие системы обеспечивают секрецию токсинов, металлопротеаз и других гидролитических ферментов у многих грамотрицательных бактерий.
Механизм их действия, как считается, одинаков и состоит в общих чертах в том, что АВС-белок в присутствии молекул АТФ узнает определенную предназначенную для секреции белковую молекулу по локализованной у С-конца последовательности, которая называется секреторным сигналом. Это было четко продемонстрировано на химерных белках, в которых к секреторному сигналу присоединяли различные не секретируемые в норме белки. Хотя не все химеры, в зависимости от размеров и структуры «белков-пассажиров», секретировались одинаково эффективно, практически всегда отмечалось, что их взаимодействие с АВС-белком имеет место. Многие из секретируемых через систему первого типа белков имеют определенное сходство в структуре, например, богатые глицином повторяющиеся последовательности, которые играют роль в связывании ионов Са2+ и в приобретении белковой цепью определенной третичной структуры. Это, как считается, может быть важным для «проталкивания» молекулы через аппарат секреции, который после связывания с АВС-белком субстрата изменяется: мембран-связующий белок меняет конформацию (условно говоря, удлиняется), присоединяется к порообразующему белку и образуется сквозной канал, обеспечивающий одношаговую секрецию.
По своей первичной последовательности АВС-белки различных организмов образуют большое семейство, члены которого выявлены у многих про- и эукариотических видов, способных к выделению белков с затратами АТФ. Все эти белки обязательно имеют гидрофобный трансмембранный домен и АТФ-связывающий сайт в гидрофильной части молекулы. Порообразующие белки, в частности TolC, в наружной мембране представляют собой тример в виде кольца с наружным диаметром 5,8 нм, причем значительная часть такой структуры выпячена в периплазму, что, вероятно, облегчает слияние с мембран-связывающим белком. Считается, что канал внутри такой структуры закрыт и открывается только тогда, когда АВС-белок связывает субстрат и мембрансвязывающий белок вследствие этого контактирует с порообразующей структурой. После того как секреция осуществлена, белки аппарата разъединяются и пора вновь оказывается закрытой. Собственно этот этап считается АТФ-независимым (гидролиза АТФ при этом не происходит), но предположительно может зависеть от создаваемого протонами мембранного потенциала.
Система секреции типа II ( или T2SS) очень широко распространена среди грамотрицательных бактерий из-за чего ее часто называют общий секреторный путь или GSP (от англ. g eneral s ecretory p athway). Примерами использования такой системы могут быть секреция пуллуланазы клетками Klebsiella oxytoca и Xcp-секреция у Pseudomonas aeruginosa. Секретируемые через такую систему белки синтезируются с N-концевой сигнальной последовательностью, которая направляет их к «секреторной машине», локализованной во внутренней мембране. После транслокации через внутреннюю мембрану по Sec-пути белки задерживаются в периплазматическом пространстве, где они приобретают нативную или близкую к нативной конформацию. Изменение конформации осуществляется с помощью специальных специфических для каждого белка шаперонов (англ. chaperon – дуэнья, тетка-воспитательница) и общих изменяющих конформацию белков, таких как Dsb-белки, катализирующие образование дисульфидных мостиков у любого белка, в последовательности которого есть серусодержащие аминокислотные остатки в нужном сочетании и положении.
Периплазматическое изменение конформации (periplasmic folding) является необходимой предпосылкой для следующего, второго, этапа секреции – перемещения через наружную мембрану. Секреторный сигнал для этого второго этапа формируется только при возникновении полной (третичной или четвертичной) структуры предназначенного для секреции протеина и выражен только тогда, когда этот белок приобретает свою окончательную, нативную, конформацию. Исходя из того, что секретируемые этим путем белки являются сложными по структуре и даже мультимерными, как, например, холерный токсин, предполагается, что проходящий через клеточную стенку и наружную мембрану канал должен иметь большой внутренний диаметр (около 95 ангстрем) и должен очень аккуратно открываться, чтобы не нарушать защитную функцию наружной мембраны. Обслуживающая этот этап секреции второго типа «молекулярная машина» включает обычно 12-15 белков.
Если рассмотреть этот путь секреции на примере бактерий Pseudomonas aeruginosa (рис. 3), то у них для второго этапа секреции типа II необходимы продукты 12 генов, xcpP-xcpZ и xcpA (мутация в любом из этих генов приводит к накоплению секретируемых белков в периплазме). Гены xcpPQ и xcpR-Z образуют два разнонаправлено транскрибируемых оперона, тогда как xcpA расположен в совершенном другом месте хромосомы.

Рис. 3. Система секреции типа II Pseudomonas aeruginosa. Sec –белковый аппарат, обеспечивающий выход белка в периплазму (см. стр.??). IM – внутренняя мембрана; OM – наружная мембрана; ch – периплазматический шаперон; RATP – белок XcpR, обладающий АТФазной активностью. Буквы латинского алфавита на изображениях белков соответствуют буквенным обозначениям белков Xcp.
Из 12 кодируемых этими генами белков только один – XcpQ – обнаруживается собственно во внешней мембране, где он формирует стабильный комплекс из 12 одинаковых молекул (12-членный гомоолигомер), имеющий форму кольца с внутренним диаметром 9,5 нм (95 ангстрем). Такие размеры поры во внешней мембране вполне обеспечивают выход белков, уже принявших в периплазме окончательную нативную структуру.
Из белков, закрепленных во внутренней мембране, особое внимание следует уделить белку XcpА. Он обладает протеазной активностью и фактически обеспечивает сборку собственно секреторного аппарата: белки XcpT, U, V, W, X синтезируются как неактивные белки-предшественники и переводятся в активную форму за счет отщепления от С-концевой части белковой цепи именно белком XcpА (рис.3). Из таких процессированных протеазой XcpА белков собирается располагающаяся в периплазме часть секреторного аппарата.
Белки XcpP, S, Y и Z также интегрированы во внутреннюю мембрану, тогда как белок XcpR связывается с внутренней мембраной через белок XcpY, N-концевой домен которого находится в цитоплазме и имеет сродство к XcpR. Сам же белок XcpR имеет АТФ-связывающий участок, так называемый Walker box A, и его отсутствие у мутантов приводит к невозможности секреции. Отсюда предполагаемая роль – обеспечение энергией процесса выведения секретируемого белка из периплазмы в окружающую среду. Функции остальных Xcp-белков еще не выяснены, предполагают, что XcpZ должен взаимодействовать с XcpY, XcpR - c XcpT, a XcpP – c секретином XcpQ. Считают, что этот комплекс Xcp-белков представляет собой динамичную структуру, способную переводить химическую энергию АТФ в механическую энергию движения периплазматической части секреторного аппарата, выводящего секретируемый белок через пору во внешней мембране. Относительно роли белков XcpP и XcpZ предполагается, что именно они контролируют открывание и закрывание канала в наружной мембране путем передачи энергии из цитоплазмы к белку XcpQ.
Из факторов патогенности Pseudomonas aeruginosa через систему типа II секретируются экзотоксин А, эластаза, липаза, фофсфолипаза С, щелочную фофсфатаза, аминопептидаза и хитинсвязывающий белок.
Система секреции типа III (T3SS), как пока считают, играет центральную роль в реализации патогенности многих грамотрицательных бактерий, как патогенных для человека и животных, так и фитопатогенов, поскольку эта система позволяет вводить факторы патогенности непосредственно в цитоплазму эукариотической хозяйской клетки. Эту систему также еще называют контактным секреционным путем, так как она включается только при контакте с определенной эукариотической клеткой и служит, по крайней мере, у некоторых из изученных в этом плане бактерий, для переключения общих секреторных процессов в оптимальный для патогена режим. Например, у фитопатогенов при внедрении в растение сначала осуществляется секреция пекто-и целлюлолитических комплексов через систему типа II, а затем, когда клеточная стенка растительной клетки разрушена и цитоплазматическая мембрана ее доступна для контакта, бактерия включает систему секреции третьего типа и отключает ранее действующую систему второго типа.
Открытым первым (в 1994 году) и наиболее изученным примером системы секреции типа III является система Yersinia enterocolitica. Девять кодирующих белки этой системы генов, обозначаемых Ysc, высоко консервативны и их гомологи обнаружены у всех бактерий, для которых система третьего типа описана. Восемь из них имеют также гомологию с генами, участвующими в процессах образования жгутиков. Кодируемые этими генами белки, как считают, нужны для формирования специфического, находящегося внутри жгутика канала через внутреннюю мембрану, который обеспечивает экспорт компонентов, необходимых для построения собственно жгутика. Один из этих белков содержит типичную АТФ-связывающую последовательность и очевидно вовлечен в передачу энергии, необходимой как для сборки «секреторной машины», так и для собственно процесса секреции. Белок YscC, не имеющий гомологии с белками биогенеза жгутиков, представляет собой, как указывалось выше, типичный секретин.
В 1998 (Kubori et al., 1998) удалось выделить из внешней мембраны Salmonella typhimurium и изучить с помощью электронного микроскопа структуры, детерминируемые генами системы секреции третьего типа. Оказалось, что по внешним контурам они похожи на инъекционную иглу, у основания которой располагаются два нижних кольца диаметром 40 нм, вероятно локализованных во внутренней мембране, и два верхних кольца, заякоривающих структуру в наружной мембране (рис.4).


Рис. 4. Строение системы секреции типа III. А - полученное с помощью электронного микроскопа изображение зоны контакта бактериальной клетки и клетки хозяина. Стрелками обозначены инъектисомы. В – инъектисомы в свободном состоянии. С – схема строения инъектисомы бактерий рода Salmonella. Буквами обозначены конкретные белки, формирующие у сальмонелл части аппарата секреции. Схема справа отражает характер действия системы: IM – внутренняя мембрана; PGN – пептидогликановый слой; OM – наружная мембрана; НМ – мембрана эукариотической (хозяйской) клетки.
Предполагается, что секретин может формировать одно или даже два верхних кольца, поскольку очищенный препарат YscC формирует в эксперименте кольцеобразные комплексы сходных размеров. Учитывая описанное сходство с иглой шприца и характер действия (введение секретируемого белка непосредственно в цитоплазму эукариотической клетки), некоторые авторы используют для описания «секреторной машины» третьего типа в полной сборке термин инъектисома.
К белкам секреторного аппарата типа III, помимо структурных белков, образующих инъектисому, относят и так называемые белки-транслокаторы. Эти белки, как считают, проводятся по каналу инъектисомы и обеспечивают прикрепление конца «иглы» к мембране эукариотической клетки и образование в ней поры. Суммарно, для нормального функционирования T3SS необходимо около двадцати белков с различными функциями – структурные белки, белки- транслокаторы, а также белки-шапероны, действующие в цитоплазме бактериальной клетки. Предполагается, что они должны предотвращать преждевременную агрегацию секретируемых белков внутри бактерии, а, возможно, и как-то способствовать прохождению их через канал.
Секретируемые через третью систему белки (они в общем смысле называются T3SS-эффекторы) очень различны, часть из них похожи на белки эукариот, но у всех у них, как предполагается, должны быть сигналы секреции у N-конца.
Значимость системы секреции типа III в определении патогенных свойств постоянно подтверждается новыми исследованиями. У ряда патогенов в геноме обнаружены по нескольку кластеров генов, кодирующих аппарат T3SS. В частности, у сальмонелл один из таких кластеров расположен в участке хромосомы, который называется SPI-1 (от англ. S almonella p athogenicity i slands – острова патогенности сальмонелл), второй – в SPI -2. С помощью T3SS, кодируемой генами из SPI-1 (SPI-1 T3SS), сальмонеллы обеспечивают себе проникновение внутрь клеток эпителия кишечника, которые изначально неспособны к фагоцитозу. Сначала передаваемые через инъектисому SPI-1 T3SS эффекторы SipA и SipC стабилизируют и переводят в глобулярное состояние актиновые нити под участком мембраны, к которому прикрепилась сальмонелла. Но они не могут обеспечить образование складок мембраны, которые необходимы для формирования эндосомы. Для этого сальмонелла передает в цитоплазму клетки эпителия следующие T3SS-эффекторы – белки SopE и SopE2. Они активируют регуляторные белки динамических перестроек цитоскелета Cdc42, Rac и RhoG, имитируя действие сигнальных активирующих белков. Одновременно еще один T3SS-эффектор белок SopB/SigD, будучи фосфатидилинозитолфосфатазой, уменьшает количество фосфатидилинозитол-4,5-бифосфата в том участке мембраны, к которому прикреплена сальмонелла, что повышает ее растягиваемость. Мембрана начинает прогибаться и ее края смыкаются, образуя эндосому, внутри которой оказывается сальмонелла. Чтобы вернуть цитоскелет клетки в нормальное состояние после образования эндосомы действует еще один T3SS-эффектор – белок SptP. Таким образом эпителиальная клетка сохраняет жизнеспособность после совершения нехарактерного для нее акта фагоцитоза.
Для выживания внутри эндосомы сальмонеллы используют вторую свою систему секреции типа III, кодируемую генами второго острова патогенности (SPI-2 T3SS). Она активируется после попадания сальмонеллы в эндосому и секретирует эффекторы, которые обеспечивают формирование из эндосом специальных мембранных везикул, так называемых SCV (от англ. S almonella - c ontaining v acuole – вакуоль, содержащая сальмонеллу). Образование SCV осуществляется в несколько этапов, включающих предотвращение доставки гидролитических ферментов к SCV, перемещение SCV в прилегающую к ядру область и образование специальных актиновых филаментов, называемых SIFs (от англ. S almonella - i nduced f ilaments – индуцируемые сальмонеллами филаменты).
Для образования SIFs, которые покрывают эндосому с сальмонеллами снаружи, фактически превращая ее в SCV необходимы SPI-2 T3SS-эффекторы SseB, SseC, SseD и SpiC. Такая «шуба» из актиновых волокон препятствует слиянию SCV с элементами комплекса Гольджи, содержащими гидролитические ферменты, а также способствует перемещению SCV в прилегающую к ядру цитоплазму. Здесь дополнительно образуются актиновые филаменты, соединяющие имеющиеся в клетке SCV в единый комплекс и обеспечивающие слияние SCV с определенными элементами комплекса Гольджи. Это те элементы комплекса Гольджи, которые, перемещаясь внутри клетки, доставляют органические молекулы в места их потребления. Когда же эти везикулы сливаются с SCV, находящиеся внутри сальмонеллы получают питательные вещества, что позволяет им не только выживать, но и размножаться. Для такого перенаправления транспорта элементов комплекса Гольджи сальмонеллы выделяют еще два SPI-2 T3SS-эффектора – белки SseF и SseG. Вспомогательные роли в этом процессе перенастройки везикулярного внутриклеточного транспорта и в процессе образования комплексов из соединенных актиновыми нитями SCV играют еще несколько SPI-2 T3SS-эффекторов – белки SseF, SseG, PipB2 и SopD2, однако точки их приложения пока не изучены.
Конечный эффект суммарного действия всех SPI-2 T3SS-эффекторов на этом этапе инфекционного процесса – это выживание и размножение клеток патогена внутри клеток эпителия кишечника хозяина, что для сальмонелл является ключевым моментом.
Подобного уровня сведения о действии T3SS–эффекторов быстрыми темпами накапливаются в настоящее время для этеропатогенных E.coli, для всех патогенных видов родов Yersinia Shigella, Bordetella, Vibrio, Pseudomons, Burkholderia, Clamidia и других. Таким образом, можно констатировать, что системы секреции типа III вносят существенный вклад во взаимодействие возбудителей болезней с их хозяевами.
Еще одной связанной с патогенезом секреторной системой является система типа IV (T4SS). По своему характеру эта система имеет сходство с системой типа III – она способна обеспечить доставку эффекторных молекул непосредственно в эукариотическую клетку. Назвать такую систему системой четвертого типа предложил G.P.C. Salmond в своем обзоре 1994 года (Secretion of extracellular virulence factors by plant pathogenic bacteria. Ann. Rev. Phytopathol. 32: 181-200), где он суммировал имевшиеся на то время сведения о функционировании системы переноса Т-ДНК из клеток агробактерий в растительную клетку. Гены, определяющие формирование и работу этой системы, локализованы в Ti-плазмидах Agrobacterium tumefaciens и составляют в ней так называемую Vir-область. При изучении этих генов и их продуктов (vir-белков A. tumefaciens) выяснилось, что они в высокой степени родственны белкам, которые у других видов бактерий обеспечивают перенос ДНК из донорской бактериальной клетки в реципиентную при конъюгации. Но поскольку эта система, вне всякого сомнения, имеет прямое отношение к развитию широко распространенного среди двудольных растений заболевания под названием корончатый галл, было предложено считать ее системой секреции факторов патогенности и вирулентности.
Первоначально считалось, что эта система секреции факторов патогенности характерна только для фитопатогенов. Однако к началу 2000-ых годов стало известно, что и у некоторых патогенов человека и других млекопитающих такая система может иметь отношение к патогенезу. В частности, Helicobacter pylori, вызывающий такие патологии, как язвенная болезнь и аденокарцинома желудка, использует родственную систему для доставки имеющего молекулярную массу 145kDa белка CagA в клетки хозяина. Под влиянием этого белка в клетках эпителия желудка начинаются перестройки цитоскелета, с их поверхности исчезают микроворсинки и клетки начинают продуцировать интелейкин-8. Кроме того показано, что Helicobacter pylori ингибирует фагоцитарную активность моноцитов и полиморфноядерных лейкоцитов. Этот антифагоцитарный фенотип также зависит от компонентов секреторной системы типа IV, а именно белков CagТ и НРО525, являющихся гомологами белков VirB7 и VirB11 A. tumefaciens соответственно.
Несколько патогенов, способных существовать в организме хозяина внутриклеточно, среди которых Legionella pneumophila, Brucella abortus, Brucella suis, Bartonella henselae (ранее называемая Rochalimaea henselae – возбудитель «болезни кошачьих царапин») и Rickettsia prowazekii, могут после их захвата фагоцитами вводить через стенку фагосомы в цитоплазму эукариотической клетки эффекторные белки, препятствующие слиянию лизосом с фагосомой. Установлено также, что вирулентность Campilobacter jejuni (возбудитель острых кишечных заболеваний, относимых к группе «диареи путешественников») поддерживается белками, гомологичными VirB-белкам бруцелл, так что этот микроорганизм, вероятно, добавляется к патогенам, использующим систему секреции типа IV.
Особый случай секреции факторов патогенности черезT4SS описан для вызывающего коклюш патогена Bordetella pertussis. Это пока единственный вид, для которого показано секреция эффектора (т.е. белка, дающего патологический эффект) через T4SS не в цитоплазму хозяйской клетки, а в межклеточное пространство. Конкретно, один из токсинов бордетелл (pertussis toxin) после транспорта системой типа IV, будучи типичным АВ-токсином с формулой АВ5, проникает в клетку слизистой оболочки трахеи самостоятельно путем связывания соответствующим рецептором на ее поверхности. Основанием для принятия такой схемы действия пертуссис-токсина является то, что девять генов ptl (p ertussis t oxin l iberation – освобождение пертуссис-токсина) Bordetella pertussis, от которых зависит его секреция, имеют высокою гомологию с virB-генами Agrobacterium tumefaciens. Эти гены расположены внепосредственной близости со структурными генами этого токсина, и мутации в ptl-генах приводят к отсутствию способности бордетелл вызывать поражение клеток, связанное с действием пертуссис-токсина.
Сведений о том, как именно транслоцируются через эту систему белки пока накоплено немного, поэтому ее описание дают применительно к переносу нуклеопротеиновых комплексов, в частности так называемого Т-комплекса, содержащего соответствующую Т-ДНК агробактерий однонитевую ДНК и белок VirD2. В классическом варианте эта система относится к sec-независимым (т.е. одноэтапным) и представляет собой собирающийся из более чем десяти различных белков канал, проходящий от внутренней мембраны бактерий через их клеточную стенку и далее через мембрану клетки хозяина (рис. 5).
Локализованные в цитоплазматической мембране белки VirВ4 и VirВ11 обладают АТФ-связывающей активностью и способностью взаимодействовать с секретируемыми субстратами. От них зависит избирательность и энергоснабжаемость системы в ходе ее функционирования.
Еще одна группа белков (VirВ7, VirВ9) имеет сродство к наружной мембране и одновременно является основой для закрепления белков VirВ2, условно называемых пилинами, из которых формируется полый пилюс, контактирующий с цитоплазматической мембраной эукариотической клетки. Белок VirВ7 интегрирован в наружную мембрану, а белки VirВ9 и VirВ10, присоединяясь своими С-концевыми частями к наружной мембране (outer membrane) изнутри, образуют так называемый О-слой (О-loyer) основного тела (main body). N-концевые участки этих же белков образуют I-слой (от англ. i nner membrane) основного тела, соприкасающийся с цитоплазматической мембраной. Количество входящих в основное тело молекул каждого из этих белков определено как 14, и они накладываются друг на друга, образуя двойные стенки.

Рис.5. Структура секреторного аппарата T4SS. IM – внутренняя мембрана, OM – наружная мембрана. Цифровые и буквенные обозначения на изображениях белков соответствуют Vir-белкам (В4 – белок VirВ4 и т.д.). CT и NT обозначают С-концевую и N-концевую части белков соответственно.
Располагающийся с цитоплазматической стороны внутренней мембраны белок VirD4 совместно с направленными в сторону периплазмы белками VirВ6 и VirВ8 обеспечивают правильную ориентацию секретируемых белков и нуклеопротеиновых комплексов.
Считается, что взаимодействие построенного из белка VirВ2 пилюса с мембраной клеток хозяина обеспечивается также белками самой секреторной системы, которые проходят через уже сформированную часть канала перед началом транспорта собственно пилинов, диффундируют через межклеточное пространство и закрепляются на мембране эукариотической клетки. Таким путем формируется место контакта далее строящегося пилюса и, предположительно, создаются условия для проникновения его через мембрану.
Хотя такая схема установления контакта еще не полностью подтверждена экспериментально, ей отдается явное предпочтение, поскольку, исходя из нее, достаточно легко объясняется широкий круг хозяев агробактерий и широкое распространение конъюгационных взаимоотношений между различными представителями грамотрицательных бактерий. Действительно, обладающие такой системой A grobacterium tumefaciens способны вызывать развитие опухоли практически у всех видов растений из класса Двудольные, а несущие плазмиды широкого круга хозяев бактерии E. сoli конъюгируют с реципиентами из практически всех видов грамотрицательных микроорганизмов. Здесь следует еще раз подчеркнуть тесное родство и, очевидно, общее эволюционное происхождение системы секреции факторов патогенности типа IV и надмолекулярных структур, называемых комплексы формирования пар скрещивания (the mating pair formation complex) - сокращенно Mpf-комплексы. Эти структуры образуются в клетках-донорах при наличии у них соответствующих tra-оперонов и представляют собой конъюгационный пилюс, обеспечивающий контакт с реципиентной клеткой и формирующий канал, через который передается одна нить ДНК при конъюгации.
Исходя из сведений, накапливающихся в последнее десятилетие, можно предполагать, что у некоторых патогенов такие системы модифицировались именно для экспорта белков, а не нуклеопротеиновых комплексов и уже существуют и функционируют под контролем регуляторных генов патогенеза, причем наряду с собственно системами конъюгационного переноса.
Система секреции типа V (T5SS) называемая также системой автотранспортеров первоначально описана у Neisseria gonorrhoeae при изучении осуществляемой ими продукции IgA1-протеазы, но затем было показано ее причастность к секреции целого ряда имеющих отношение к патогенности и вирулентности белков, в частности адгезинов. В этой системе С-концевая последовательность самого белка определяет экспорт N-терминального домена через наружную мембрану, что и послужило основанием для наименования этой системы.
Большинство автотранспортеров несет N-концевую сигнальную последовательность, разрешающую выход в периплазматическое пространство с использованием Sec-машины, работающей, как описано выше (стр.??), в системе секреции типа II. Причем большинство сигнальных последовательностей у автотранспортеров необычно длинные, что может отражать необходимость некоторых дополнительных требований для транспорта этих белков через внутреннюю мембрану. N-концевая сигнальная последовательность примыкает к домену α, за которым следует С-концевой домен β. Последний имеет характеристики белков наружной мембраны и предназначен для формирования пронизывающей мембрану бочкообразной (barrel) структуры, стенки которой состоят из 10-14 петель полипептидной цепи β-домена, находящейся не в α-, а в β-конфигурации (вторичной структуре). Такой, условно говоря, бочонок не имеет дна и крышки, и через него перемещается домен α, называемый также «домен-пассажир». Эта сформированная β-доменом пора по расчетам должна быть узкой, поэтому предполагается, что α-домен проталкивается как близкая к линейной структура. В соответствии с этим было показано, что введение в район α-домена дисульфидных мостиков ингибирует секрецию. Не решенным вопросом остается как этот домен, будучи, фактически, только во вторичной структуре, сохраняет эту структуру и при этом не подвергается действию протеаз в течение контакта с наружной мембраной и при перемещении через нее. Возможно, что периплазматические шапероны играют здесь какую-то роль или же что часть самого белка играет роль внутримолекулярного шаперона. Противоположные гипотезы предполагают, что транспорт через внутреннюю и внешнюю мембраны может быть объединенным процессом. В этом отношении необычно длинный секреторный сигнал может играть определенную роль.
До сих пор остается невыясненным вопрос, в любое ли место наружной мембраны может встраиваться β-домен секретируемых по типу V белков. Многие авторы считают, что в этой системе должны работать специальные белки, предварительно встраивающиеся в наружную мембрану и тем самым определяющие место образования β-бочонка. На роль такого белка претендует протеин Omp85/YaeT, который имеется у многих видов бактерий, а также в мембранах митохондрий и пластид эукариот. Однако прямых доказательств участия Omp85/YaeT в интеграции β-доменов секретируемых по типу V белков пока не получено.
После выхода на наружную поверхность клетки судьба “пассажиров” оказывается различной в зависимости от того, что секретируется. Два домена могут оставаться ковалентно или нековалентно связанными или же α-домен может протеолитически отщепляться и функционировать самостоятельно уже во внеклеточном пространстве. Отщепление может происходить как автокаталитически, так и, в некоторых случаях, с участием локализуемых во внешней мембране протеаз.
В том случае, когда домен-пассажир остается ковалентно связанным с β-доменом, он играет в большинстве случаев роль адгезина, то есть фактора патогенности, обеспечивающего прикрепление к тканям организма-хозяина. В частности, адгезины Escherichia coli AIDA-I и Ag43, адгезин YadA Yersinia enterocolitica и Yersinia pseudotuberculosis, адгезин Hia Haemophilus influenzae, адгезин Prn Bordetella pertussis являются типичными белками-аутотранспортерами.
Для освободившихся α-доменов прежде всего установлена роль протеаз. Кроме уже упоминавшейся IgA1-протеазы Neisseria gonorrheae и Neisseria meningitidis показано участие в патогенезе ряда сериновых протеаз энтеробактерий. Они даже получили собственное название, чаще всего используемое в виде аббревиатуры – SPATE (от англ. the s erine p rotease a uto t ransporters of E nterobacteriaceae). Эти протеазы относятся к группе цитотоксинов типа V (см. стр.??) и их примерами являются протеолитический токсин Pet и геамагглютинирующий/гемоглобинсвязывающий токсин Tsh/Hbp штаммов Escherichia coli, вызывающих «диарею путешественников», диарею детей первого года жизни и персистентную диарею у ВИЧ-инфицированных. Сюда же попадают токсин SepA Shigella flexneri, токсин PrtS клинических штаммов Serratia marcescens, протеазы- муциназы Pic и SepA различных видов шигелл. Из не относящихся к энтеробактериям патогенов, способных секретировать протеазы по пути секреции V можно назвать Haemophilus influenzae (Hap-белок) и Bordetella pertussis (протеаза SphB1 проидающий резистентность к комплементу белок BrkA). Кроме того, белками-аутотранспортерами являются эстераза EstA Pseudomonas aeruginosa и токсин VacA Helicobacter pylori.
Следует отметить, что все эти белки имеют достаточно большие молекулярные массы, превышающие массы тех белков, которые секретируются через системы типа I и типа II. Существует мнение, что систему типа V следует рассматривать как специализированную для транспорта крупных белков, поэтому в обзорах последних лет в эту систему включают и рассматриваемую ранее отдельно так называемую двупартнерную систему секреции или в английской аббревиатуре TPS (от the t wo- p artner s ecretion). Основанием для этого служит следующее.
В TPS-системе секретируемый белок, обозначаемый TpsА, переносится в периплазматическое пространство с помощью Sec-машины независимо от второго партнера – белка TpsВ, для чего у каждого из этих белков на N-концах имеются соответствующие сигнальные последовательности. Белки TpsВ имеют пространственную структуру, очень похожую на β-домен белков-аутотранспортеров, и после встраивания в наружную мембрану образуют пору-бочонок из 10-12 петель с β-структурой, через которую и секретируется белок TpsА. То есть фактически основное отличие от типичной системы секреции типа V заключается в том, что, условно говоря, α- и β-домены разобщены, но при секреции кодирующие их гены всегда экспрессируются совместно и для каждого TpsА есть свой TpsВ.
Примерами секретируемых таким путем факторов патогенности являются цитолизин ShlA Serratia marcescens (соответствующий ему TpsВ называется ShlB), цитолизин EthA Edwardsiella tarda (TpsВ – EthB), адгезины HMW1 и HMW2 Haemophilus influenza e, (TpsВ - HMW1В и HMW2B соответственно), адгезины LspA1 и LspA2 Haemophilus ducreyi (TpsВ - LspB1и LspB2 соотвественно), филаментозный гемагглютинин FHA Bordetella pertussis (TpsВ – FhaC). Все эти белки имеют большие молекулярные массы и состоят не менее чем из 3000 аминокислотных остатков. Наибольший из секретируемых таким путем белков обнаружен при протеомном анализе Pseudomonas aeruginosa PAO1 - его масса составляет 361 594 Da, а количество аминокислотных остатков - 5 627.
Система секреции типа VI (T6SS) описано недавно. В начале 2000-х годов при анализе сиквенсов островов патогенности возбудителей различных болезней было зафиксировано консервативное семейство генов, функции которых на тот момент были не ясны. Но к 2006 году удалось установить, что продукты этих генов формируют специализированную секреторную систему, функционально сходную с системами типа III и IV - система обеспечивает доставку секретируемого белка непосредственно в цитоплазму хозяйских клеток.
Согласно данным, полученным при анализе нуклеотидных последовательностей патогенов человека и животных, около четверти возбудителей обладают такой системой. В основном это представители отдела Proteobacteria, в частности Vibrio cholerae, Edwardsiella tarda, Pseudomonas aeruginosa, Francisella tularensis и Burkholderia mallei, но кроме этого сходные группы генов обнаружены у почвенных и водных бактерий из пока еще плохо изученных отделов Planctomycetes и Acidobacteria. Предполагается, что у непатогенных бактерий T6SS может иметь отношение к образованию биопленок, и патогены могли получить кодирующую эту систему гены в результате горизонтального переноса генетической информации.
Количество генов, входящих в T6SS-кластеры, колеблется от 15 до 25, и пока еще не все продукты этих генов охарактеризованы структурно и функционально. Из хорошо охарактеризованных и имеющих отношение к структурной части системы типа VI можно привести белок Hcp (от англ. h emolysin c oregulated p rotein) и белок VgrG (от англ. v aline– g lycine r epeat protein G), описанные для энтеропатогенного штамма E. coli O157: H7. Гомологи этих белков или кодирующие их гены у других видов бактерий могут иметь иные названия, но их наличие считается критерием присутствия у данных бактерий T6SS.
В экспериментах с выделенным и очищенным белком Hcp было установлено, что он способен образовывать кольцевые олигомеры из шести молекул, которые затем объединяются в трубочки с внутренним диаметром 40 ангстрем и длиной около 100 нанометров.
Белок VgrG имеет ярко выраженное структурное сходство с белками бактериофага Т4, которые формируют так называемую «иглу» (the needle complex) на конце хвостового отростка. С помощью этого комплекса бактериофаг прокалывает мембрану и вводит свою ДНК в цитоплазму бактериальной клетки. В образующих «иглу» белках gp27 и gp5 бактериофага имеются характерные β-спиральные участки в С-концевом домене, от которых зависит их способность проходить через мембрану. Именно такие участки обнаружены в белке VgrG и его аналогов у других бактерий. Кроме того, белки бактериофага образуют комплексы из трех молекул (тримеры), которые затем и собираются в «иглу». Белок VgrG также спонтанно образует триммер.
Эти данные послужили основой для создания предположительной модели действия T6SS (рис. 6).

Рис. 6. Схема сборки и функционирования T6SS (пояснения приведены в основном тексте).
Согласно приведенной схеме на этапе (a) в результате активации генов кластера T6SS в цитоплазме бактериальной клетки появляются мономеры белков Hcp и VgrG, которые с помощью еще не охарактеризованного комплекса белков во внутренней мембране (inner membrane complex) перемещаются в периплазматическое пространство. Здесь из мономеров Hcp формируются гексамерные кольца (hexameric rings), а из мономеров VgrG – тример (VgrG trimer). Тример VgrG объединяется с одним из гексамеров Hcp, и затем снизу к этому гексамеру последовательно присоединяются новые гексамерные кольца. С этого момента начинается этап (b), в ходе которого удлиняющаяся полая структура из молекул Hcp (Hcp tube) с тримером из молекул VgrG на конце проходит через клеточную стенку, наружную мембрану и растет до соприкосновения с мембраной эукариотической клетки (host membrane). Тример VgrG проделывает в мембране отверстие, и растущая трубка входит в цитоплазму эукариотической клетки (host cytosol). На этапе (c) на молекулах VgrG обнажается активный С-концевой домен, который может взаимодействовать с какими-либо мишенями в эукариотической клетке. В частности, для белка VgrG Vibrio cholerae показана актинсвязывающая активность, и предполагается, что тример VgrG отделяется от конца трубки, тем самым освобождая проход для передаваемых из бактериальной клетки T6SS-эффекторов, но сам при этом тоже действует как эффектор – повреждает цитоскелет клетки, перекрестно связывая актиновые нити (effector-domain activity).
Описанная модель действия T6SS, конечно же, далека от совершенства, но в ходе дальнейшего изучения роли этой системы секреции в определении патогенных свойств бактерий она несомненно будет корректироваться и уточняться.
Последней из систем секреции, которая уже получила цифровое наименование, является система секреции типа VII (T7SS). Ее существование было предсказано в конце 1990-х годов при анализе полной последовательности генома типового штамма возбудителя туберкулеза Mycobacterium tuberculosis H37 Rv, и далее подтверждено в ходе экспериментальной работы с другими штаммами Mycobacterium tuberculosis и другими видами рода Mycobacterium – M. bovis, M. avium, M.marinum.
Особенностью всех микобактерий является необычное строение их клеточных стенок. По химическому составу и архитектуре расположенных над цитоплазматической мембраной слоев эти бактерии ближе к грамположительным – у них отсутствует периплазматическое пространство, имеется примыкающий к мембране пептидогликановый слой, но не имеется характерной для грамотрицательных бактерий наружной липопротеиновой мембраны. Однако, в отличие от типичных грамположительных бактерий, у относящихся к отделу Actinobacteria микобактерий в клеточной стенке муреиновые комплексы чередуются с комплексами из арабиногалактана, к которым присоединены молекулы миколовых кислот. Эти кислоты представляют собой особо длинные (количество атомов углерода в пределах 70 – 90) и разветвленные (боковые цепи содержат до 24 атомов углерода) жирные кислоты, и плотность их расположения такова, что из них формируется слой толщиной 8-10 нанометров. Как и положено жирным кислотам, они не растворимы в воде, к тому же между ними располагаются молекулы так называемых свободных гликолипидов сложного состава (фтиоцеролдимикокерозаты, фосфотидилинозитолманнозиты, сульфолипиды, димикотрегалоза, она же корд-фактор, и др.), которые еще больше повышают гидрофобность этого слоя. В связи с этим эту часть клеточной стенки называют микомембраной.
Наличие микомембраны коррелирует с относительно малым количеством секретируемых в окружающую среду белков, причем у тех, которые секретируются, отсутствуют сигнальные последовательности, характерные для белков, транспортируемых через системы секреции типов I – VI. Поэтому, когда геномный анализ показал наличие у микобактерий около 10% процентов генов¸ кодирующих белки необычного аминокислотного состава, встал вопрос о роли этих белков в жизнедеятельности и патогенности возбудителей туберкулеза.
Такие белки отличаются наличием повторяющихся сочетаний либо остатков пролина и глютаминовой кислоты, из-за чего в английской аббревиатуре их называют РЕ-белки (Е – обозначение глютаминовой кислоты в однобуквенной системе)¸ либо пролина, пролина, и глютаминовой кислоты (соответственно эти белки называются РРЕ). Кодирующие эти белки гены в геноме микобактерий чаще всего образуют кластеры с генами, которые кодируют мембранассоциированные белки и белки с АТФазной активностью, обычно участвующие у других бактерий в секреции. Это позволило предположить, что такие кластеры кодируют белки систем секреции и их стали называть ESX. Название было дано как аббревиатура от английской фразы ESAT-6 secretion system Х, поскольку структура собственно системы секреции еще была неизвестна. Белок же ESAT-6 уже был известен как один из факторов патогенности микобактерий, и его название происходит от фразы early secreted antigenic target of 6 kDa – рано активируемая антигенная мишень с массой 6 кД. Реально этот белок вызывает образование пор в мембране эритроцитов и приводит их к гибели, а также обеспечивает выход микобактерий из фагосомы в цитоплазму фагоцитов на стадии внутриклеточного существования. Вспомогательным белком для ESAT-6 является белок CFP-10 (от англ. culture filtrate protein of 10 kDa – белок культуральной жидкости с массой 10 кД). Ген, который кодирует CFP-10, находится в одном опероне с геном, кодирующим ESAT-6, и они экспрессируются совместно. Оба эти белка относятся к семейству РРЕ.
Дальнейшее изучение геномов микобактерий показало, что у разных видов микобактерий соответствующие ESX кластеры генов могут повторяться до 5 раз, сочетаясь с генами различных белков из семейств РЕ и РРЕ. Тогда первое открытое сочетание генов секреции и генов секретируемых белков стали называть ESX-1, а остальные соответственно получали названия от ESX-2 до ESX-5. В 2007 году было предложено все эти варианты относить к типу секреции VII.
Существенно, что количество ESX-систем достаточно хорошо коррелирует с уровнем патогенности микобатерий. Самые патогенные виды рода Mycobacterium (так называемые медленно растущие M.avium, M.bovis, M.marinum, M.tuberculosis, M.leprae) имеют в своем геноме все пять ESX. Быстрорастущие и менее патогенные M.smegmatis и M.gilvum имеют только три таких кластера.
Еще одним свидетельством причастности системы секреции типа VII к патогенным свойствам является отсутствие у вакцинного штамма BCG (бацилла Кельмета-Герена, широко применяемая для профилактики туберкулеза живая вакцина) одного из кластеров (ESX-1). Получилось так, что еще в впервой половине 20-го века эмпирически удалось отобрать штамм с делецией части хромосомы, которая сделала его не вирулентным, но оставила высоко иммуногенным. Это еще раз подтверждает, что только совокупность всех пяти вариантов ESX-систем делают штаммы высокопатогенными.
Механизм действия и строение секреторного аппарата типа VII изучены пока мало, но в общих чертах на примере секреции комплекса ESAT-6--CFP-10предполагается следующая схема (рис.7).

Рис.7. Предположительная схема работы системы секреции типа VII. ММ – микомебрана клеточной стенки Mycobacterium tuberculosis. IМ – цитоплазматическая мембрана Mycobacterium tuberculosis. Остальные пояснения приводятся в основном тексте.
Белок ESAT-6 после синтеза на рибосомах объединяется с цитоплазматическим белком-шапероном CFP-10, образуя пригодный для секреции гетеродимерный комплекс ESAT-6--CFP-10. Этот комплекс распознается белком Rv3871, который присоединяется к С-концевому участку белка CFP-10. Далее белок Rv3871 связывается с локализованным в цитоплазматической мембране белком Rv3870, образуя активную АТФазу, которая предположительно должна снабжать процесс секреции энергией.
К этому времени в цитоплазматической мембране уже должен быть сформирована пора из белка Rv3877 (этот белок выбрали для такой роли из-за того, что он имеет 11 трансмембранных доменов), в который и направляется секретируемый комплекс. Одновременно с этим комплексом по пока еще не определенной схеме к каналу направляется белок Rv3616с (его второе название EspA), поскольку экспериментально установлено, что EspA и комплекс ESAT-6--CFP-10 всегда секретируются совместно, хотя во внешней среде обнаруживаются как отдельные частицы.
Из каких белков строится проходящий через микомембрану канал и как он соединяется с порой во внутренней мембране, пока не установлено. Не определена и роль белка Rv3868, который по своей аминокислотной последовательности должен быть ААА+ - белком (от англ. A TPases A ssociated with diverse cellular A ctivities – так называют АТФазы, участвующие в очень различных внутриклеточных процессах как в клетках прокариот, так и в клетках эукариот), но предполагается, что он должен снабжать энергией процесс сборки секреторного аппарата.
В отношении функций показанных на рис. 7 других свободных цитоплазматических белков и белков, интегрированных в мембрану, сведений пока нет, но их отсутствие сказывается на секреции EspA и комплекса ESAT-6--CFP-10.
К настоящему времени гены, гомологичные ESX-генам микобактерий, обнаружены у некоторых грамположительных микроорганизмов, в частности, у Corynebacterium diphtheria, Staphylococcus aureus, Streptococcus agalactiae, Bacillus subtilis, Listeria monocytogenes, Streptomyces coelicolor. Это позволяет некоторым авторам утверждать, что первоначально считавшаяся чисто микобактериальной система секреции типа VII, должна рассматриваться как общая секреторная система для грамположительных бактерий из отделов Actinobacteria и Firmicutes.
Еще одной важной для патогенеза системой секреции является специализированная система для построения фимбрий и пилюсов различного назначения на поверхности клеток грамотрицательных бактерий. Она не получила цифрового наименования и называется CU секреционный путь (chaperone/usher secretion pathway или chaperone/usher machinery). В русскоязычном изложении это может звучать как секреция, опосредованная взаимодействием шаперонов и «швейцаров». Из возможных вариантов перевода словаusher слово швейцар кажется наиболее приемлемым, исходя из той роли, которую исполняют локализованные в наружной мембране молекулы.
Образуемые с помощью такой системы пилюсы и фимбрии наиболее выражены у представителей класса Gamma- Proteobacteria и используются патогенными бактериями в основном для прикрепления к клеткам хозяина на первых стадиях его колонизации. В частности, для патогенных энтеробактерий (энтеропатогенных эшерихий, сальмонелл, йерсиний, протеев) так называемые фимбриальные адгезины являются основными факторами вирулентности и при их отсутствии инфекционный процесс фактически не развивается. У Yersinia pestis имеются особого строения фимбрии, образующиеся на поверхности клетки в большом количестве и формирующие своеобразную «шубу», защищающую такие клетки от фагоцитоза. У многих бактерий такие пилюсы и фимбрии задействованы в формировании биопленок на твердых поверхностях и микроколоний при существовании в жидкой среде. Показано также, что собственно белки пилей и фимбрий, вводимые в чистом виде в организм лабораторных животных, вызывают мощные воспалительные процессы и развитие иммунных ответов на присущие им антигеннные детерминанты. Это позволяет рассматривать их как самостоятельные факторы вирулентности, действующие не только на этапах адгезии и колонизации, но и на более поздних стадиях инфекционного процесса.
Морфологически собираемые с помощью CU-системы структуры делятся на две группы. Это могут быть короткие, достаточно жесткие, палочковидные структуры, состоящие из субъединиц одного (реже двух) типов, количество которых обычно более 1000. Диаметр таких пилюсов 7-8 нанометров, а длина около 2 микрометров На верхнем конце таких пилюсов имеются более узкий (около 2 нанометров) гибкий кончик длиной около 40 нанометров, который и определяет адгезивные свойства. Такое строение имеют так называемые Р-пилюсы энтеробактерий. К этой же структурной группе CU-пилюсов относят пилюсы типа 1 энтеропатогенных эшерихий. Они несколько тоньше и короче, чем Р-пилюсы, и имеют более короткий (10-19 нанометров) гибкий кончик.
Вторую морфологическую группу CU-пилюсов составляют типичные гибкие фимбрии, по диаметру сопоставимые с концевыми отростками Р-пилюсов и пилюсов типа 1. Это изначально гибкие состоящие приблизительно из 1000 одинаковых субъединиц структуры, которые могут переплетаться и соединяться друг с другом, образуя подобие капсулы или «шубу» на поверхности бактериальной клетки. Такое строение характерно для фимбрий, формирующих так называемую F1-капсулу у Yersinia pestis.
Структурные гены белков-пилинов, необходимых для формирования такой конкретной поверхностной структуры, обычно располагаются в одном кластере с генами, кодирующими белки соответствующего секреционного аппарата – шапероны и белки- швейцары (ushers). Активность этих генов регулируется координировано, что и обеспечивает быстрое образование необходимых пилюсов и фимбрий после получения бактериальной клеткой определенного сигнала.
Несмотря на отличия конкретных шаперонов и швейцаров по специфичности, они сохраняют общий характерный способ функционирования, поэтому можно рассмотреть действие CU-системы на примере обобщенной схемы.
Эту систему следует отнести к двухэтапным или Sec-зависимым (рис.8). Молекулы белков-пилинов по мере их синтеза на рибосомах
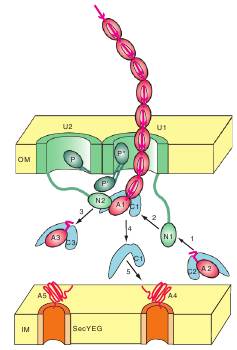
Рис. 8. Схема работы CU секреционного пути. ОМ - наружная мембрана, IM – цитоплазматическая мембрана, А1-А5 – белковые субъединицы пилюса, С1-С3 – периплазматические шапероны, U1 и U2 – две молекулы-швейцары, N1и N2 – N-концевые домены двух различных молекул-швейцаров, P – вильчатый домен швейцара 2, P’и P” – два возможных положения вильчатого домена швейцара 1. Стрелки и цифры обозначают происходящие в периплазме этапы функционирования системы и направления перемещения молекул в ходе них.
направляются к цитоплазматической мембране и с помощью секреторной машины (SecYEG) выводятся в периплазматическое пространство. В периплазме к это времени уже находятся специфические периплазматические шапероны, структура которых позволяет быстро присоединять к себе соответствующий пилин. Два домена в таком шапероне расположены в пространстве так, чтобы между ними могла поместиться молекула пилина, а специальная петля на N-концевом домене пилина попала в определенное место на стыке двух доменов шаперона. Такой характер связывания пилина с шапероном предотвращает преждевременный фолдинг пилина, защищает его от разрушения периплазматическими протеазами и одновременно обеспечивает возможность контакта на следующем этапе с такой же молекулой пилина в основании строящегося пилюса или фимбрии. Заканчивается первый этап перемещением такого комплекса пилин-шаперон к уже сформировавшемуся в наружной мембране сочетанию двух молекул-швейцаров. Каждая встроенная в мембрану молекула-швейцар устроена таким образом, что ее С-концевой участок образует пору в мембране, а N-концевой домен свободно перемещается с внутренней стороны наружной мембраны.
На втором этапе свободный N-концевой домен одного из швейцаров связывается с шапероном этого комплекса и перемещает комплекс к основанию строящегося пилюса. При этом уже находящийся здесь ранее пришедший комплекс пилин-шаперон распадается: имеющийся в нем пилин остается связанным со швейцаром, а шаперон освобождается (на схеме это этап 4). Подходящий в этом момент комплекс занимает его место, новая молекула пилина оказывается рядом с уже прикрепленной и соединяется с ней. В это время новый комплекс пилин-шаперон с помощью N-концевого домена второго шаперона перемещается сюда же, предшествующий комплекс распадается, пилин из него присоединяется к основанию растущего пилюса, а шаперон уходит для связывания новой молекулы пилина. Таким образом, действуя попеременно, молекулы-швейцары наращивают пилюс от основания до полного его построения и проталкивают нарастающую структуру через пору одного из швейцаров. Суммируя роль швейцаров, можно сказать, что они являются своеобразной платформой для сборки, закрепления в мембране и перемещения строящегося пилюса на наружную поверхность, проявляя тем самым и структурную, и каталитическую, и динамическую (двигательную) активность.
Заканчивая рассмотрение систем секреции факторов патогенности и вирулентности, надо отметить их многообразие и одновременно широкую распространенность некоторых из них среди бактерий различных систематических групп. Важно также и то, что многие патогенные бактерии имеют целый набор различных систем секреции и используют их в различные этапы своих жизненных циклов. Детальное изучение уже известных систем, и поиск новых интенсивно продолжаются и являются в настоящее время одними из приоритетнейших направлений современной медицинской микробиологии. Полученные в ходе таких исследований знания ложатся в основу методов профилактики и терапии инфекционных заболеваний.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3939; Нарушение авторских прав?; Мы поможем в написании вашей работы!