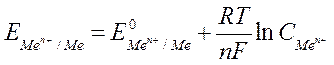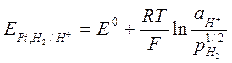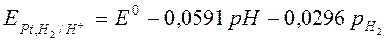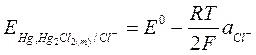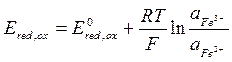КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроды I и II рода. Электроды сравнения. Окислительно-восстановительные электроды
|
|
|
|
Уравнение Нернста для электродного потенциала.
Для разбавленных растворов 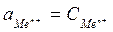 , тогда уравнение Нернста примет вид:
, тогда уравнение Нернста примет вид:
|
Электроды в зависимости от того относительно какого иона они обратимы делятся на два класса – электроды первого и второго родов, иначе называемые индикаторными электродами, поскольку их потенциал однозначно зависит от концентрации определенного вида ионов в растворе.
1)Электроды I рода – представляет собой металл, погруженный в раствор, содержащий ионы этого же металла. Электроды I рода обратимы относительно катионов. Записываются как
Ме | Men+; 
На электроде протекает реакция
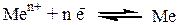
Потенциал электрода зависит от активности катиона:
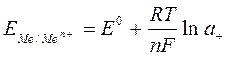
Пример: серебряный электрод (Ag | Ag+);
медный электрод (Cu | Cu2+);
водородный электрод (Pt, H2 | H+).
2) Электроды II рода – представляют собой металл, покрытый слоем малорастворимой соли и погруженный в раствор, насыщенный этой солью и содержащий другую легкорастворимую соль с тем же анионом. Обратимы относительно анионов. Записывается как
Me, MeA (т) | An-; 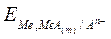
На электроде протекает реакция:

Потенциал электрода зависит от активности аниона:

Пример: каломельный и хлорсеребряный электроды.
Ag, AgCl (т) | Cl-; Hg, Hg2Cl2 (т) | Cl-
Рассмотрим другие типы электродов.
Электрод сравнения – это электрод, у которого точно известен электродный потенциал. С электродами сравнения сравнивают другие электроды, чем потенциала необходимо установить.
Электроды сравнения бывают следующими:
I. Стандартный водородный (газовый) электрод – является основным электродом сравнения.
Представляет собой платинированную платиновую пластинку погруженную в водный раствор HCl или серной кислоты H2SO4. Через раствор проникает ток чистого Н2 под постоянным давлением. Записывается как
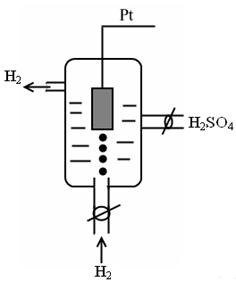 Pt, H2 | H+, aq;
Pt, H2 | H+, aq;
а) если давление Н2 равно 1 атм., а активность раствора равна 1, то это стандартный водородный электрод для которого условно считают что  .
.
Pt, H2 | H+, aq; 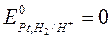
p = 1 атм. а Н+ = 1
б) если  ,
,  , то это нестандартный водородный электрод,
, то это нестандартный водородный электрод, 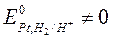 .
.
Pt, H2 | H+, aq; 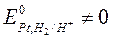
p ≠ 1 атм. а Н+ ≠ 1
На электроде протекает следующая обратимая электрохимическая реакция:
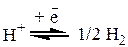

Выведем уравнение для электродного потенциала нестандартного водородного электрода (или называется газовый электрод).
Для этого составляем элемент, у которого слева стандартный водородный электрод с 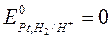 , а справа обычный водородный электрод с потенциалом
, а справа обычный водородный электрод с потенциалом 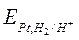 . Тогда э.д.с. этого элемента равна:
. Тогда э.д.с. этого элемента равна:
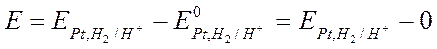 ;
; 
Т. к.  , то
, то  ; z = 1
; z = 1
Изменение энергии Гиббса равно:
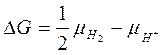
где  ; (в газообразном состоянии)
; (в газообразном состоянии)
 ; (в растворе)
; (в растворе)
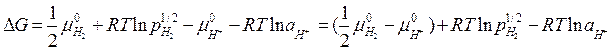
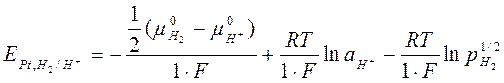
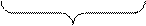
Е0 = 0
|
т. к.  , то
, то
|
Потенциал водородного электрода уменьшается с повышением давления Н2 на электроде. Водородный электрод обратим относительно катиона.
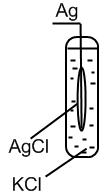
II. Каломельный электрод: более простое устройство, служит вспомогательным электродом сравнения, его потенциал точно известен относительно стандартного электрода.
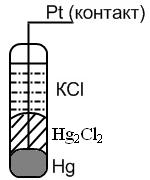 Представляет собой ртутный электрод, покрытый труднорастворимой солью Hg2Cl2 – каломелью и погруженный в раствор, насыщенный этой же солью (каломелью) и содержащий другую легкорастворимую соль с тем же анионом хлорид калия KСl.
Представляет собой ртутный электрод, покрытый труднорастворимой солью Hg2Cl2 – каломелью и погруженный в раствор, насыщенный этой же солью (каломелью) и содержащий другую легкорастворимую соль с тем же анионом хлорид калия KСl.
Записывается как:
Hg, Hg2Cl2 (т) | Cl-; 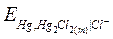
На электроде протекает реакция:

Пользуясь уравнением Нернста, запишем электродный потенциал:

Поскольку раствор насыщен труднорастворимой камелью, то произведение активностей ионов будет постоянно: 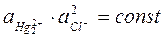
Отсюда: 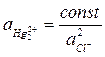

|
|
Потенциал электрода зависит от активности Cl- (т. е. она задается концентрацией соли КСl, т. к. концентрация каломели постоянна, поскольку ею насыщенный раствор). Если используется 1 н раствор КСl – нормальный каломельный электрод, если 0,1 н – децинормальный, если насыщенный раствор КСl, то насыщенный каломельный электрод.
Каломельный электрод обратим относительно аниона.
 III. Хлорсеребряный электрод – также используется в качестве электрода сравнения.
III. Хлорсеребряный электрод – также используется в качестве электрода сравнения.
Представляет собой серебряный электрод, покрытый малорастворимой солью AgCl и погруженный в раствор, насыщенный этой солью и содержащий другую легкорастворимую соль с тем же анионом КСl.
Записывается как:
Ag, AgCl (т) | Cl-, aq; 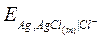
На электроде протекает реакция:
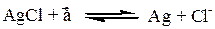
Уравнение для электродного потенциала равно:

Хлорсеребряный электрод обратим относительно аниона Сl-.
Рассмотрим другой тип электродов, у которых электрохимические реакции получения или отдачи электронов не связаны с окислением или восстановлением электродов (из электролита выделяется вещество и восстанавливает электрод). В таких электродах электрохимические реакции связаны с изменением валентности ионов в растворе. Электрод обменивается с электролитом не ионами, а электронами. Это так называемые окислительно-восстановительные электроды.
Окислительно-восстановительные электроды представляют собой инертный металл, погруженный в раствор, который содержит окислительную и восстановительную форму металла. Инертный металл обменивается с раствором электролита не ионами, а электронами.
Записывается как
Mem+(red.), Men+(ox) | Pt
На электроде протекает реакция:

Потенциал окислительно-восстановительного электрода зависит от активностей окислительной и восстановительной формы ионов:
|
Потенциал окислительно-восстановительного электрода называется окислительно-восстановительным или редокспотенциалом.
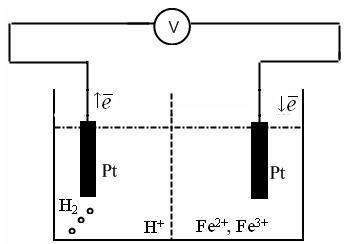 Пример: для определения окислительно-восстановительного потенциала составим следующий электрохимический элемент – слева стандартный водородный электрод, а справа окислительно-восстановительный электрод – платина, опущенная в раствор, содержащий FeCl2 и FeCl3.
Пример: для определения окислительно-восстановительного потенциала составим следующий электрохимический элемент – слева стандартный водородный электрод, а справа окислительно-восстановительный электрод – платина, опущенная в раствор, содержащий FeCl2 и FeCl3.
(-) Pt, H2 | H+ || Fe2+, Fe3+ | Pt (+)
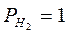

Атомы платины не участвуют в электродном процессе, а служат лишь переносчиками электронов. От платинового электрода электроны переходят к ионам Fe3+ и восстанавливают их до Fe2+.
В элементе протекают следующие электрохимические реакции:

Поскольку Е0 =0 на катоде, то для расчета будем учитывать реакцию только на аноде.
Тогда
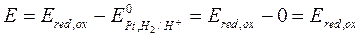 ;
; 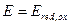 ;
;
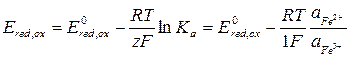
Тогда имеем
|
Окислительно-восстановительные электроды могут быть составлены и на основе органических окислительно-восстановительных систем. Особый интерес представляет хингидронный электрод.
Хингидронный электрод – это платиновый электрод, погруженный в раствор хингидрона (насыщенный раствор с кристалликами хингидрона):
[C6H4O2 ∙ C6H4(OH)2], aq | Pt
Органическое соединение хингидрон – это труднорастворимое в воде соединение хинона и гидрохинона с водородной связью.
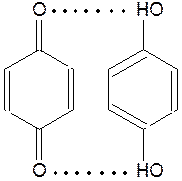
|
В растворе хингидрон частично распадается (т. е. диссоциирует) на хинон и гидрохинон
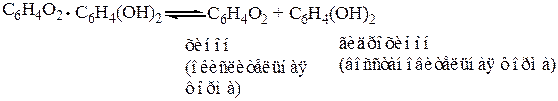
Для определения электродного потенциала хингидронного электрода составим следующий гальванический элемент:
(-) Pt, H2 | H+, aq || [C6H4O2 ∙ C6H4(OH)2], aq | Pt (+)




в растворе есть Н+, т. к.
гидрохинон слабая кислота способная
диссоциировать с образованием Н+
Тогда:


Рассмотрим Ех, г для правого электрода. Согласно уравнению Нернста для Е будем иметь следующее:
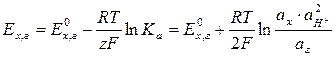
В насыщенном растворе хингидрона соотношение  постоянно, а значит и
постоянно, а значит и  . Тогда
. Тогда
|


Потенциал хингидронного электрода зависит от 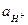 в растворителе и от Т. Хингидронный электрод нельзя использовать в щелочных растворах, так как гидрохинон, как слабая кислота, будет сильно диссоциировать на ионы и его концентрация будет непостоянной (то есть не будет соблюдаться соотношение
в растворителе и от Т. Хингидронный электрод нельзя использовать в щелочных растворах, так как гидрохинон, как слабая кислота, будет сильно диссоциировать на ионы и его концентрация будет непостоянной (то есть не будет соблюдаться соотношение 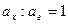 ).
).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 19289; Нарушение авторских прав?; Мы поможем в написании вашей работы!