
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
1. Теплота не может самопроизвольно переходить от холодного к горячему телу.
2. Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу.
Возьмем какой-либо процесс, в котором система переходит из состояния I в состояние II. Один раз по пути 1, а второй раз по пути 2. При этом на каждом элементе пути перехода, на котором Т можно принять постоянной, поглощается  количество теплоты. Если процесс системы обратим, то просуммировав теплоты, деленные на соответствующие Т для любого пути из I в II, получаем одну и ту же величину, а взяв интеграл по замкнутому контуру, т.е. вернув систему в прежнее состояние, увидим, что интеграл равен нулю
количество теплоты. Если процесс системы обратим, то просуммировав теплоты, деленные на соответствующие Т для любого пути из I в II, получаем одну и ту же величину, а взяв интеграл по замкнутому контуру, т.е. вернув систему в прежнее состояние, увидим, что интеграл равен нулю
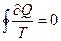 .
.
Из математики известно, что если  , то имеется некоторая функция от тех же переменных величин
, то имеется некоторая функция от тех же переменных величин 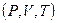 , полный дифференциал которой равен подинтегральной величине. В термодинамике Клаузиусом эта термодинамическая функция была названа энтропией.
, полный дифференциал которой равен подинтегральной величине. В термодинамике Клаузиусом эта термодинамическая функция была названа энтропией.
 ,
,
 (для обратимых процессов).
(для обратимых процессов).
Для необратимых процессов изменение энтропии всегда больше нуля
 ;
;  .
.
По мере самопроизвольного протекания необратимого процесса, его энтропия возрастает и в состоянии равновесия она достигает своего максимального значения
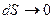 ,
,
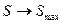 .
.
Энтропия является количественной мерой необратимости процесса, мерой бесполезного тепла или деградацией (рассеяния) энергии. Для изолированной системы при 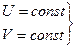 .
.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!